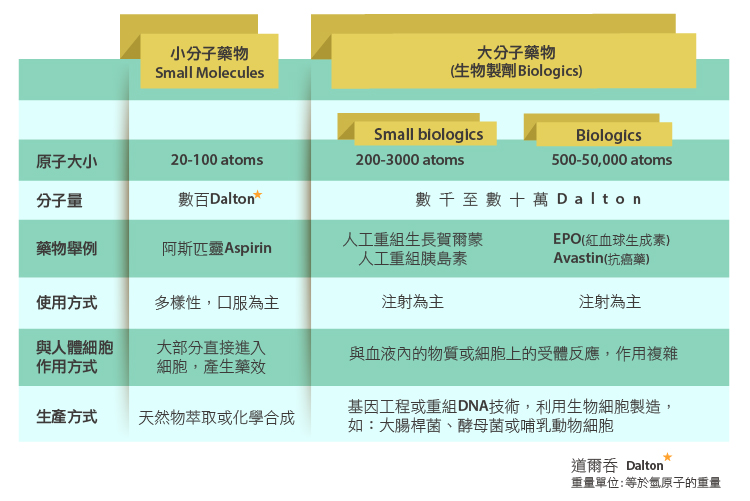
大小分子藥品
現代製藥產業可回溯至1897年德國的化學家Hoffimann由柳樹樹皮與樹葉分離萃取出可治療關節炎之阿斯匹靈Aspirin。當時對於疾病的致病原因尚未釐清,只能依靠隨機篩選來找到有價值的藥品,效率極低。而後隨著不斷的研究,1950年代由於機械化生產、安全性相關法規尚未確立、及化學工程專業技術轉移等等因素,製藥產業才可算是蓬勃發展起來。
1953年,James Watson及Francis Crick發現了DNA雙股螺旋的結構,揭開細胞基因的神秘面紗。接著,1973年Cohen與Boyer發明了基因重組技術,隨著相關的生物學、生化學、分析化學及藥理學的進步,製藥產業開始有了新的分支。在1980年代中第一個生技藥品上市後,藥品不再只是簡單的化學成分(小分子藥物Small molecule drugs),而是結構越趨複雜的生物製劑Biologics(大分子藥物/蛋白質藥品)。
小分子藥物Small Molecule Drugs
傳統的小分子藥物主要是由一連串的化學步驟製成的,分子量(小於500)相較於蛋白質藥品小很多,也較簡單,其定性與定量的技術多半已相當成熟,分析檢驗方法也有完善的法規可以依循,當專利過期之後,其他藥廠若要仿製成學名藥,難度較低,競爭亦較激烈。其劑型的變化也多,如口服、注射、經皮吸收、黏膜吸收等等。
藥品依組成份可分為原料藥(含中間體)及製劑,原料藥為藥劑中之有效成分,可經由複雜的有機化學反應或是由天然物萃取分離純化而來。製劑則是將原料藥加工製成一定劑型及劑量之藥品,製劑又可分為處方藥(Ethical drugs, Rx)及非處方藥(Over-the-counter drugs, OTC),處方藥須由醫生開立處方,再經由藥師給藥;非處方藥則是經由處方藥轉變而來,經長期應用、確認療效及安全性、品質穩定、非醫療專業人員也能安全使用的藥物。
生物製劑Biologics(大分子藥物,蛋白質藥物)
大分子藥物係利用基因工程與細胞培養等技術在微生物、植物或動物細胞製造所得的蛋白質、胜肽及其衍生物,如:細胞激素(cytokines)、成長因子(growth factor)、荷爾蒙(hormones)、單株抗體或基因重組蛋白質疫苗(recombinant DNA protein vaccines)等,並用於疾病治療。
其結構複雜,且易受外在環境影響而改變,而這些蛋白質需要有正確的立體結構才能在適當的部位進行反應,進而達到藥理和生理上的作用。因此在製程的要求上更為嚴格,需要投入大量的心力和時間進行品質特性(Quality Attributes)的研究,有了全面的了解,才能對製程加以控管,達到產品的穩定性與批次的一致性。
蛋白質藥物需要特定的結構才能做作用,故擁有選擇性高,副作用較傳統小分子藥物低的優點,其製程技術門檻高,不易仿製,產業價值也較高,故各大廠爭相發展生技藥品,以提高利潤。
由於人口成長及老化、對於健康的警覺性增加,許多嚴重疾病目前仍無解決之道,提高了對於新藥的需求,政府也輔以政策的支持,訂定許多相關產業發展的方針。
民國98年至101年推動「臺灣生技起飛鑽石行動方案」(簡稱鑽石行動方案),促成設立食品藥物管理局(TFDA),著手建置與國際銜接法規環境,加入PIC/S GMP國際品質組織,強化國內生技醫藥研發單位,啟動成立生技整合育成中心,提供整體服務平台,使得台灣生技製藥新上市(櫃)公司大增,而後於民國101年,由於醫療與產業需求轉變,修正名稱為「臺灣生技產業 起飛行動方案」(簡稱本方案),期於102年至104年,調整策略,導入創新服務思維,以求在藥品、醫療器材、醫療管理服務三個領域有更進一步的突破。生技藥物可謂21世紀的明星產業。




電商毛利率保衛戰_-.png)









中小航運公司開始重新買船-大洗牌後航運“新周期”真開啟了?_-.png)




超商創新服務的佼佼者.jpg)