2014 年3月確認爆發伊波拉疫情,隨著死亡人數不斷攀升,各國卻束手無策!

8月在美國傳出一線希望,一個仍在實驗中的藥品-ZMapp,可能有機會成為這次阻止恐慌的國際英雄,但後來馬普藥廠稱,已將所有藥品送至疫區,需耗時二至三個月才能製出少量藥品。國際各大藥廠與政府協力投入救援、阻止疫情再擴散,陸續傳出一些好消息,即使是缺乏大量試驗數據的實驗中藥品,隨著治癒人數慢慢累積,仍讓民眾降低恐慌程度。
伊波拉病毒並不是第一次爆發感染,伊波拉病毒有五種亞型,1976年時薩伊伊波拉病毒(Zaire ebolavirus)首度被發現,當時感染318人並造成280人死亡。由於高死亡率而引起注意,開始有部分學者進行研究。
在2011年發表在Nature期刊的一篇研究報告中顯示,伊波拉病毒必須藉由細胞膜上的Niemann–Pick C1(NPC1)蛋白質才能感染人類細胞,也因此,興起了「只要阻礙NPC1作用即可以防止病毒感染」的假說,進而朝NPC 1 抑制劑發展,但由於NPC1亦擔任運輸膽固醇(Cholesterol)的重責,若NPC1缺乏或失去作用,會引起退化性失調,細胞會塞滿膽固醇,最終會死亡。療效與副作用中該如何取捨,以及實驗藥物該如何修改是一大難題。
既然伊波拉感染人類的機轉早在2011年就有學者提出,卻直至今日,在爆發大規模感染的嚴重情況下,仍無已核准上市的藥品可用,只能緊急挪用尚未進行臨床試驗的藥品來救急?
其實一個新藥從研發、臨床試驗、通過查驗登記、上市接著送到消費者端, 是一條極為漫長的道路,期間需投入龐大的人力、金錢和時間成本,也需要可靠的試驗數據支持級嚴格的法規把關,才能在符合效益的前提下確保用藥者的安全。
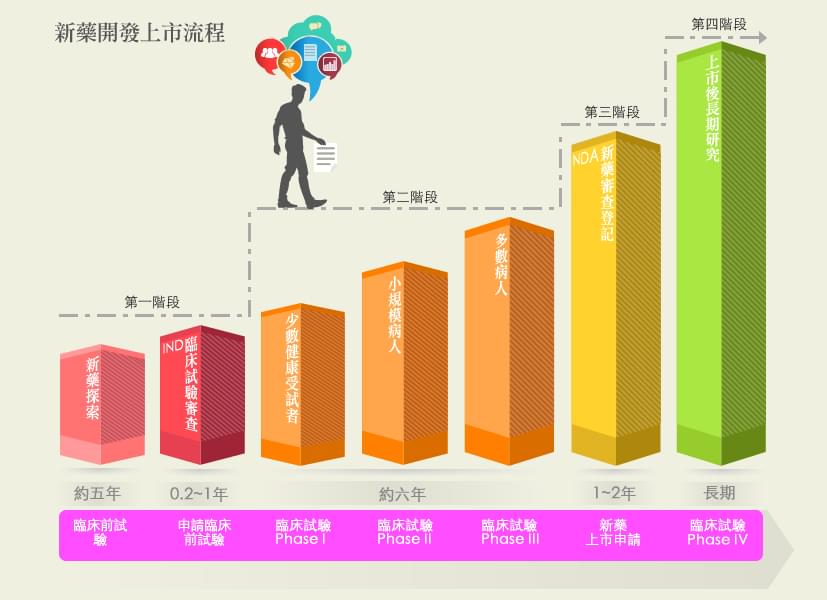
若只能依循正常步驟一步一步慢慢來,一旦遇到無法應付的嚴重或緊急狀況,則緩不濟急。加上近年開發上市的新藥數量趨緩,仍有許多疾病無藥可治,稱為「未被滿足的醫藥需求(unmet medical need)」。以美國為首的醫藥先進國家,針對所謂的嚴重疾病及未被滿足需求的疾病,如AIDS、阿茲海默症等等,推出一些特殊的臨床試驗設計和審查程序的上市審查規範,統稱為嚴重疾病用藥促進計劃(Expedited Programs for Serious Conditions)。
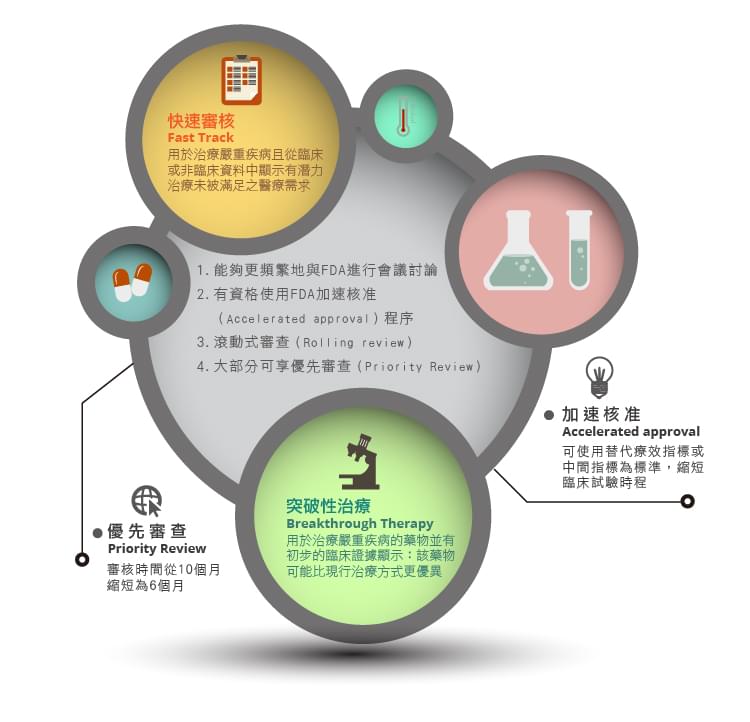
嚴重疾病用藥促進計劃(Expedited Programs for Serious Conditions)含了四個主要內容:
- 快速通道機制Fast Track
- 突破性治療Breakthrough Therapy
- 加速核准機制Accelerated Approval
- 優先審查Priority Review
這四個計劃來自不同法源、有不同的審核標準及目的且相輔相成,針對以開發「現行治療(Available conditions)」下仍「未被滿足的醫療需求(Unmet medical need)」的「嚴重疾病(Serious conditions)」的治療藥物為核心,來推動新藥開發到上市的速度。
若符合以下三個條件的開發中候選藥品,則有機會可以採用嚴重疾病用藥促進計劃來加快整個開發上市過程,且可以得到FDA相當的幫助。
- 現行治療(Available therapy):在美國已被上市核准的治療方式。
- 未被滿足的醫療需求(unmet medical need):指以現行治療仍無法適當處理的治療或診斷。
- 嚴重疾病(Serious conditions):會影響日常生活功能且有致死可能性的疾病即算是。
根據2014年8月29日BBC Health 上的新聞,實驗性藥物Zmapp除了在18隻猴子身上100%有效,更在進一步的研究報告中,指出即使是感染晚期投藥也能發揮藥效。此消息令人振奮,因條件符合,所以美國官方也全力協助Zmapp的開發,更在10月16日發佈任務命令, 要求三個先進生物實驗室提出生產Zmapp的計劃。
快速通道機制Fast Track
Fast Track是用來促進新藥開發及加速用來治療嚴重疾病或滿足未被滿足的醫藥需求的藥物之審查程序。使有迫切醫療需求的患者可有機會使用新的治療藥品。
任何發展用於目前尚未有治療方法或藥物的疾病都可視為滿足一個未被滿足的醫藥需求。若已有治療方式的疾病,候選藥物必須展現比現行治療更佳的優勢,如展現更佳的療效、避免現行治療方式產生的嚴重副作用等等。
取得Fast Track的資格的優勢:
- 能夠更頻繁地與FDA進行會議討論與書信往來研議例如臨床試驗設計的議題。於試驗開始前或試驗早期盡可能與FDA溝通確保過程中遇到的問題能被解決。
- 有資格使用FDA加速核准(Accelerated approval)程序,例如:使用替代指標或中間指標進行臨床試驗等。
- 滾動式審查(Rolling review),在新藥上市許可申請(NDA, New Drug Application)送審資料時可分次送件,不需等到全部資料都完成後才能送件。一般的新藥上市許可申請的審查都是要等藥廠把完整的資料都送件後才會開始進行審查。
大部分取得Fast Track資格的藥物都可以得到優先審查(Priority Review)的特別待遇。
Fast Track必須由藥廠主動提出申請。在藥物的開發階段的任何時點都可以提出申請,理想上,應該在生物製劑上市申請(BLA)/新藥上市申請(NDA)前的會議之前提出。FDA將審核該申請並在收件日起60日內進行確認且給予答覆。
突破性治療 Breakthrough Therapy
用於治療嚴重疾病且初步的臨床證據已經證明實驗藥物已遠較現行治療為優良,可採用「突破性治療」計畫來加速實驗藥物的開發與審核程序。評估的標準為根據臨床上觀察到的療效及結果,或以療效指標來評估是否比現行治療方式更能改善。
除了一般標準所用的臨床試驗療效指標(Endpoint),若以加速核准機制中所採用的替代療效指標或中間療效指標為標準,亦表現其療效。或者,根據替代療效指標或中間療效指標的結果,可以預測未來臨床上有意義的效益。若與表現出的療效不低於現行療法,但用藥安全大幅提升亦可算是符合資格。
藥物取得突破性治療之後可以得到全部快速通道機制Fast Track具有的獎勵,且在臨床試驗初期就能獲得FDA在藥物開發計劃上的指引。
突破性治療是由藥廠提出申請。若藥廠沒有主動提出申請,當藥物發展可能符合申請標準時FDA會主動建議藥廠考慮提出突破性治療的申請。若資格符合,最好在二期臨床試驗會議結束前提出突破性治療申請,因為授與突破性治療資格的目的是在於:讓可用來支持新藥上市的臨床證據能夠儘可能有效率地被審核確認。FDA亦會於突破性治療申請收件後60天內做出回應。
當發展藥品獲選「快速審查計劃」或是「突破性治療計劃」後,並不表示已確定可以申請上市,若更進一步的大型試驗中發現療效較現行療法低,則FDA將會發文件通知藥廠,並說明不再被納入「快速審查計畫」、或「突破性治療計畫」的原因。
加速核准機制Accelerated Approval
申請加速核准的新藥必須有支持其對嚴重或危及生命的疾病具有療效與安全性,且可提供患者優於現行療法的效益。
符合資格的發展中藥品可以替代療效指標代替臨床療效指標來縮短臨床試驗的時程,未來需於上市後繼續執行確認性臨床試驗(Post marketing clinical study),因顧慮到患者權益,必須在指定的醫療院所、具特殊資格的醫師才能開立處方,若上市後臨床試驗無法證明其療效或無法確保患者用藥安全,則有被撤銷藥品許可證的可能性。
優先審查(Priority Review)
新藥上市許可申請(NDA, New Drug Application)的審查分為標準審查(Standard Review)及優先審查(Priority Review)。取得優先審查資格者,FDA會以6個月內完成審查為目標(一般的標準審查大約要花10個月),但不影響臨床試驗的時程和期間,亦不影響新藥上市審核所需的科學及醫學上的實證資料。
FDA有權決定每一個申請案的審查方式,且已把相關的法規條件公告,以利廠商參考。

此次伊波拉肆虐,世界衛生組織與各國政府合作,召集醫療專家協力阻止這場浩劫,其中與美國FDA最為密切,因目前實驗中的可能有效藥品,多半是由美國的生技公司或藥廠所開發,即使安全性資料及臨床療效尚未經過大型的臨床試驗驗證,但經由這些法案的內容,可知政府及醫療組織並非貿然將實驗藥物用於患者,而是為了全體人民的權益,依循法規審核且開會討論後才執行。
目前除了使用實驗藥品之外,最重要的是提供患者完善的支持性療法,妥善的做好隔離及防護措施;而住在非疫區的民眾,儘量避免前往高危險的國家,才能真正確保自身健康安全。








找藉口很簡單-改善投資績效卻很難.png)



