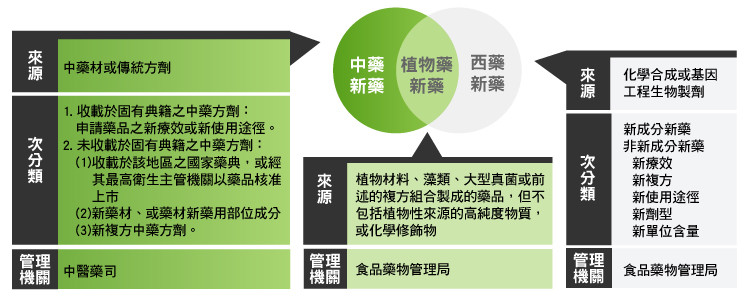
以中草藥來治療疾病,在中國已有數千年的歷史,臺灣承襲中華文化,在國內則形成中醫與西醫並存的二種醫療模式,藥物的審查也分屬於不同機關。中醫用藥的主管機關為中醫藥司(舊稱為中醫藥委員會),以傳統中醫藥理論基礎訂定「中藥新藥」管理制度;而西醫的用藥則為食品藥物管理局 (TFDA) 所管轄,以完全符合西藥管理規範所執行,訂定「植物藥新藥」管理制度。
中藥新藥
提起中藥,相信大家都不陌生,甚至已經將其融入日常生活中的藥療食補了。中藥在過去稱之為官藥,在西方醫學傳入中國後,為了與西醫藥物區別,而逐漸改稱「中藥」,亦將中國傳統醫學稱為「中醫」。現今以中醫理論為基礎,使用防治疾病功能植物、動物、礦物以及其加工品,為人類治療或預防疾病之藥材,不論產地,稱為中藥。
將原藥材經過處理加工處理的藥材片子,仍可辨識內部組織結構,供中醫調配處方的中藥稱為飲片。現今為了提升服藥方便性、維持品質穩定,衛福部核准藥廠依照古籍方劑將生藥煎煮成濃縮浸膏藥液,再與澱粉混合乾燥成便於口服的「科學中藥」,意即並非經科學方法驗證療效和安全性才稱為科學中藥。
中醫相較於西醫,較偏向經驗醫學,然而中藥如同西藥皆是「藥」,以往民眾多半誤解中藥是完全無毒、無副作用。台灣越來越重視中藥與中藥新藥的開發,訂定「中藥新藥」,希望透過較嚴謹地規範開發流程,達到對成品之安全性與療效的要求,也逐步設立中藥臨床試驗中心,推動我國中藥產業技術升級,期望未來能帶給民眾更安全有效的中藥產品。
法規中所明定之中藥為不含業經高度純化,或經化學合成或修飾之下列各款藥品,若符合以下條件則可稱為「中藥新藥」:

植物藥新藥
植物藥廣泛而言是指以天然植物藥材為原料,具有治療、預防或診斷的效果,包含了東方的中草藥及西方的民間草藥。
近年來以天然草本植物來源為基礎的藥物開發,逐漸引起製藥產業的注意,隨著老年人口漸增及消費者追求天然的趨勢,市場需求一直有增無減,植物藥已廣泛地運用於疾病治療及疾病症狀的改善。且因目前部份小分子化學藥物毒性高、副作用較大,許多重大疾病 ,如癌症、老年癡呆症、神經系統疾病、免疫治療、類風濕性關節炎等的治療效果仍有很大的改善空間,更加提升了大眾對於植物新藥開發的期待。
衛生署前後設立了中藥新藥與植物藥新藥管理制度,其中植物藥新藥管理制度主要為規範已有人類使用經驗之植物藥材,其依傳統或非傳統方法抽取之抽取物所製成之新藥,但並非如同西藥那般純化到只剩單一有效成分。此植物藥新藥在性質和管理上較接近西藥,主管機關與西藥同為食品藥物管理局,植物新藥可謂中西兼容並蓄的代表。
根據植物藥新藥相關法規,無論是以植物材料、藻類、大型真菌或前述的複方為來源,且符合中央衛生主管機關審查認定屬新成分、新療效複方或新使用途徑製劑之藥品,即可稱為植物新藥。但若是經基因轉殖、雖是植物來源但已經過高度純化的物質(以其中單一成份做成藥品,如抗癌藥紫杉醇)、或是經化學修飾(加入人工化學改良,如山藥萃取合成的雌激素),則僅有其植物性部分屬於此規範內,例如如若該藥品含有大豆萃取物及以山藥萃取物合成的雌激素,「植物藥新藥查驗登記基準」只適用於大豆萃取物的部分。
一般在合成或高度純化藥品的西藥新藥臨床試驗申請與查驗登記時,希望能鑑定出活性成分;但在植物藥方面,活性成分的鑑定並非絕對必要。
植物新藥與西藥較明顯的差別在於:
- 藥材來源的生物多樣性
- 藥材組成的複雜多元性
- 具有傳統人體使用的有效經驗
- 具傳統人體使用的安全性經驗的特色與挑戰
在台灣,經過傳統或現代抽提方法獲得之藥品,若宣稱西醫診斷系統之適應症,廠商可以自行選擇走中藥新藥或是植物藥新藥途徑來申請。
植物藥市場
以目前全球市場來看,歐洲是全球最大的植物藥市場之一,在歐盟各國都有植物性產品的使用。其次是亞洲地區及美洲。至今世界各國使用植物藥的經驗各不相同,管理方式也不同,植物藥的定義、分類及上市審核的程序上,亦無統一的原則及方針。
歐洲國家中雖以德國和法國認可植物藥的療效,在使用上有較悠久的歷史和也已建立較完善的法規,而其他國家多半將植物藥歸類於營養補充品,管理較不嚴謹,但近來歐盟致力推動植物藥產品審查法規的一致化,在歐洲醫藥品管理局(European Medicine Evaluation Agency, EMEA)的架構下,成立植物藥產品委員會(Committee On Herbal Medicinal Products , HMPC),其前身為歐洲植物藥工作小組(Herbal Medicinal Product Working Party, HMPWP),修訂了「植物藥藥物品質」(Quality of Herbal Medicinal Products)。
美國是以西藥藥品為主的國家,在實務上缺少植物藥品使用的經驗。因此在西元 2004 年美國 FDA 公布了「植物性產品規範法案」(Guidance for Industry – Botanical Drug Products),強調療效與安全性,內容訂定了植物藥進入美國藥品市場的兩個途徑:申請新藥查驗登記(New Drug Application)成為『植物新藥』上市或是進入成藥系統(OTC system)在藥局販售。此法案開啟了植物藥進入北美及歐洲主流醫藥市場的可能性,尤其對於使用中草藥經驗豐富的亞洲地區更是個大好機會。可惜截至今日為止,成功案例不多,第一個被核可的植物新藥為處方藥(sinecatechins, Veregen®),係一綠茶茶葉萃取物,用來治療病毒感染的疣,而其他產品仍在審查中。(註)
中國中藥的創新研發已有數十年,核准上市的中藥新藥也超過千種之多,對於植物藥的定義和管理也與台灣大不相同,其產品也以內需市場為主。其不斷研發創新的態度值得台灣業者學習借鏡。
台灣政府也鼓勵植物性新藥研發,目前有不少植物性新藥正在走入臨床試驗階段,相信台灣廠商在醫療產業可以有更多元的發展。

植物新藥開發的優勢
一般西藥藥品的安全性與臨床療效評估模式是適用於植物藥新藥的。目前開發中的植物新藥大多是由已經使用多年、具有明顯臨床治療效果的藥用植物。因此,若具備國內或國外人體使用經驗 (包括以食品型式合法上市,或收載於固有典籍內),在安全無虞與相關資料充足的考量下,FDA同意有些配方可以直接進入臨床二期、甚至三期人體試驗,此舉大幅降低新藥開發成本,縮短不少藥物研發時程!
在上述美國公佈的法案中,FDA強調:植物藥品的有效化學成分不清楚是可以被接受的,進一步的分離純化不是必須執行的要件。因此植物藥若是具有傳統人體使用的有效性與安全性的經驗,只要具備良好的化學製造與管制 (CMC,Chemistry、Manufacturing、Control),的能力,核准上市的可能性將會大增。
植物新藥開發的難題
植物新藥原料來自於天然植物,而天然產品本身就具備了生物多樣性及藥品組成的複雜多元性。在採收上也容易因種植方式、採收季節及儲藏運輸等因素而影響其批次品質成份,因此含量的均一性非常不易維持。同一批藥材,不同批次生產所得的原料藥,其產率與品質差異遠大於化學合成藥,更遑論不同批次、不同年份、不同批量藥材生產的原料藥,差異可能更大!因此如何制訂適切的原料藥規格為植物藥研發的一個重要關鍵點。
在申請植物新藥查驗登記時,食品藥物管理局 (TFDA) 於法規中提及,可在臨床三期 (Phase III) 時使用至少3個不同批次的產品,再以統計方法比較各批次間療效是否有顯著差異,以此法確定植物新藥內的活性成分。

植物藥的最終產品形式可分為『植物新藥』及『保健食品』。植物新藥的研發時程久,雖獲利利潤較高但風險也較大,而保健食品雖具有疾病預防的效果但相關法規的限制卻不像植物新藥上市的繁複與嚴格。因此,許多生技公司或藥廠都將保健食品作為公司發展短中期獲利的產品,以支撐植物新藥產品未上市前的研發經營資金需求。
但台灣工銀科技顧問公司協理羅敏菁女士曾在書中發表過,最不利植物新藥開發的阻力就是『保健食品』公司。原因乃植物新藥不易靠申請專利保護市場的獨占利益:植物藥通常為使用已久的天然產品,療效已知,最多只能申請生產製程的專利,而製程不過幾種,很難有原創性,不易申請專利。是故,當原開發藥廠耗費大量資金證明某種植物藥的療效時,其他保健食品廠商很快的就可以讓此產品充斥市場,搶掉商機!
近年來由於傳統醫學的療效及用藥理論逐漸受到重視與肯定,並且可彌補西方醫學不足之處。全球植物藥市場有極大的發展潛力,估計每年均以10~20%的速度快速成長,在2012年達到221億美元,預估2017年,將可成長至266億美元!惟植物藥成份複雜,藥材規格因產地氣候的差異,使有效成分不易掌握,如何挑選植物新藥題材及植物藥材的品管控制則是未來製藥廠商必須克服的挑戰!
(註) 讀者Joy提供:
2012年,FDA核可第二個植物新藥FULYZAQ® (Crofelemer),用於緩解 HIV/AIDS患者,在接受抗反轉錄病毒治療(ART)時出現的非感染性腹瀉症狀。