燃料電池與傳統電池的差異
傳統電池直接使用化學反應產生能量(電子),優點是能量轉換效率很高(80% 以上),但是充電需要比較長的時間;而使用燃料以內燃機進行燃燒反應產生能量,優點是可以直接補充燃料,但是使用內燃機的能量轉換效率很低(20% 以下 ),科學家開始思考,有沒有一種方法同時具有「電池」與「燃料」的優點呢?於是燃料電池從此誕生了。
燃料電池和傳統電池的原理相同,都是將活性物質的化學能轉換成電能,但是傳統電池的電極本身是活性物質,會參與化學反應;而燃料電池的電極本身只是儲存容器而已,並不會參與化學反應,必須將活性物質加入電池內(就好像我們的汽車補充燃料一樣 ),才能產生化學反應形成電能,是一種要補充燃料的電池,故稱為「燃料電池(Fuel cell)」。」
燃料電池的原理
燃料電池的原理很簡單,陽極(負極)通入氫氣或其他含有氫原子的燃料(例如:甲醇),經過金屬觸媒催化產生電子與氫離子(H+),電子流入元件可以推動電子元件工作,也就是我們所稱的電能,如<圖一(a)>所示;氫離子則流入電解液或質子交換膜,如<圖一(b)>所示。
陰極(正極)通入氧化劑(例如:氧氣),經過金屬觸媒催化吸收電子形成氫氧離子(OH-),氫氧離子流入電解質或質子交換膜,如 < 圖一(c)> 所示;最後氫離子(H+)與氫氧離子(OH-)結合形成水(H2O),如<圖一(d)>所示。電解質主要的功能是用來傳導氫離子或氫氧離子,通常都是強酸或強鹼。
其實要使用氫氣與氧氣產生能量,最簡單的方法就是燃燒,可是燃燒必須使用內燃機,前面介紹過內燃機的能量轉換效率低於 20 %,而燃料電池直接使用氫氣與氧氣進行化學反應,理論上可以將能量轉換效率提高到 80% 以上,顯然燃料電池同時具有「 電池 」高能量轉換效率與「燃料」可以快速補充的優點。
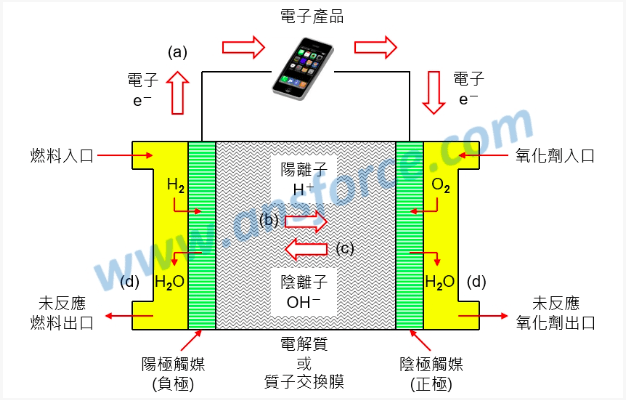
圖一、燃料電池的原理與構造
燃料電池的燃料
➤直接使用氫氣做為燃料:
如果陽極通入氫氣做為燃料,則可以直接流入陽極,經過金屬觸媒催化產生電子與氫離子,並且和陰極流入的氫氧離子結合形成水。
➤使用含有氫原子的化合物做為燃料:
使用含有氫原子的化合物做為燃料來產生氫氣,例如:甲烷(CH4)、甲醇(CH3OH),甚至汽油(己、庚、辛、壬烷的混合物)、生質酒精、沼氣等,都可以經由金屬觸媒引發「改質反應(Reforming reaction)」產生氫氣,再流入陽極,經過金屬觸媒催化產生電子與氫離子,並且和陰極流入的氫氧離子結合形成水。
可惜的是,觸媒的改質反應通常只能將少量的甲醇或甲烷轉換成氫氣(通常低於 10% ),其餘大部分都是轉換成二氧化碳或一氧化碳,所以轉換效率很低。
【重要觀念】
➤觸媒(Catalyst):是指可以引發化學反應的固體,通常是貴重金屬固體,它可以使原本不會產生的化學反應發生,也可以加快化學反應速率,而且反應前後觸媒本身並不會改變。
❐ 鹼性燃料電池(AFC:Alkaline Fuel Cell)
使用石綿網做為電解質的載體,氫氧化鉀(KOH)溶液做為電解質傳導陽離子與陰離子,操作溫度大約 70~200 度 C,屬於「低溫型燃料電池」,陽極必須使用純度很高的氫氣做為燃料,陰極必須使用純度很高的氧氣做為氧化劑,金屬觸媒使用鉑、金、銀等貴重金屬或鎳、鈷、錳等過渡金屬,目前已經成功地應用在航太工業或軍事用途,比較不適合做為民生用途,能量轉換效率可達 40~50%。
❐ 質子交換膜燃料電池(PEMFC:Proton Exchange Membrance Fuel Cell)
使用多孔性的質子交換膜來取代電解質傳導陽離子與陰離子,質子交換膜只含有水份,由於不含強酸或強鹼所以沒有腐蝕的問題,操作溫度低於 100 度 C,屬於「低溫型燃料電池」,陽極使用氫氣(H2)或其他含有氫原子的燃料,陰極使用氧氣,金屬觸媒使用鉑、金、銀等貴重金屬或鎳、鈷、錳等過渡金屬,由於壽命長、穩定性高、操作溫度低,可以廣泛應用在行動式車輛與電子產品上,能量轉換效率可達 40~50%。
PEMFC 的關鍵材料為質子交換膜,目前市場上效率最好的質子交換膜是由美國杜邦(DuPont, DD-US)(EI Du Pont De Nemours And Co, DD-US)公司所生產的 Nafion,主要的成份為「聚全氟磺酸」;此外,日本的 Asahi Chemical 公司、美國的 Dow Chemical 公司也都有類似的產品,由於質子交換膜的專利權掌握在少數公司手中,再加上貴重金屬觸媒的價格很高,所以這種燃料電池難以普及。
❐ 磷酸燃料電池(PAFC:Phosphoric Acid Fuel Cell)
使用純磷酸做為電解質傳導陽離子與陰離子,操作溫度大約 160~220 度 C,屬於「中溫型燃料電池」,陽極使用氫氣(H2)或其他含有氫原子的燃料,陰極使用氧氣,金屬觸媒使用鉑、金、銀等貴重金屬或鎳、鈷、錳等過渡金屬,由於壽命長、穩定性高,是第一個做為民生用途的燃料電池,但是啟動到穩定發電需要比較長的時間,所以不適合做為備用發電機,能量轉換效率可達 40~50%。
❐ 熔融碳酸鹽燃料電池(MCFC:Molten Carbonate Fuel Cell)
使用多孔性陶瓷(氧化鋰鋁)做為電解質的載體,熔融狀態的鹼性碳酸鹽做為電解質傳導陽離子與陰離子,操作溫度大約 600~800 度 C,屬於「高溫型燃料電池」,陽極使用氫氣(H2)或其他含有氫原子的燃料,陰極使用氧氣,由於在高溫下操作,化學反應可以自然發生,不需要使用貴重的金屬觸媒,所以價格較低,但是這種電池壽命短、穩定性低,而且啟動到穩定發電需要比較長的時間,所以不適合做為備用發電機,能量轉換效率可達 50~60%。
❐ 固態氧化物燃料電池(SOFC:Solid Oxide Fuel Cell)
使用固態陶瓷 YSZ(氧化釔-氧化鋯:Y2O3-ZrO2)做為電解質傳導陽離子與陰離子,由於電解質內不含強酸或強鹼所以沒有腐蝕的問題,操作溫度大約 600~1,000 度 C,屬於「高溫型燃料電池」,陽極使用甲烷(CH4)或其他含有氫原子的燃料,並且使用鈷-氧化鋯(Co-ZrO2)或鎳-氧化鋯(Ni-ZrO2)做為觸媒,陰極使用氧氣,並且使用鍶-錳酸鑭(Sr-LaMnO3)做為觸媒,由於操作溫度較高,金屬與陶瓷之間密封不易,而且啟動到穩定發電需要比較長的時間,所以不適合做為備用發電機,能量轉換效率可達 50~60%。
❐ 直接甲醇燃料電池(DMFC:Direct Methanol Fuel Cell)
結構與質子交換膜燃料電池(PEMFC)相似,使用多孔性的質子交換膜來取代電解質傳導陽離子與陰離子,質子交換膜只含有水份,由於不含強酸或強鹼所以沒有腐蝕的問題,操作溫度低於 100 度 C,屬於「低溫型燃料電池」。最大的不同是,質子交換膜燃料電池(PEMFC)的陽極通入含有氫原子的燃料(例如:甲醇)時,必須先將甲醇(CH3OH)經由觸媒的改質反應(Reforming reaction)形成氫氣,才能流入陽極;而直接甲醇燃料電池(DMFC)是直接將甲醇流入陽極,並且和陰極流入的氫氧離子反應,產生水與二氧化碳,其中甲醇分子裏的氫原子產生水(H2O),碳原子產生二氧化碳(CO2)。
DMFC 的陰極使用氧氣,金屬觸媒使用釕、錸、鉬、鎢等貴重金屬或過渡金屬,由於電池結構簡單,而且啟動到穩定發電需要時間很短,再加上具有穩定性高、操作溫度低、補充燃料方便等優點,是目前唯一可以廣泛應用在各種行動式車輛與電子產品的燃料電池,可惜能量轉換效率較低是唯一的缺點,目前可以達到 30% 左右。此外,也有科學家使用奈米觸媒將這種燃料電池製作成體積很小的「微型燃料電池」,可以應用在手機、PDA、筆記型電腦等手持式電子產品中,能量密度比鋰電池高出數十倍,可以讓手機待機超過 100 天以上,不過奈米觸媒成本較高,而且質子交換膜價格也高,商業化仍然有困難。
❐ 燃料電池的優點
➤能量轉換效率高:燃料電池不需要使用內燃機,所以不受卡諾定理的限制,理論上能量轉換效率可以達到 90% 以上,目前工業上實際生產的燃料電池能量轉換效率大約 40~60% 左右,但是仍然有提升的空間。
➤充電時間短:傳統的電池充電必須花費很長的時間,等待逆向化學反應結束後才能完成充電,燃料電池直接補充燃料即可,所以充電的方式和使用內燃機的方式完全相同,非常方便。
➤反應噪音低:目前的火力發電、水力發電、核能發電等技術都必須使用汽輪機推動發電機,運轉時噪音很大,燃料電池是單純的化學反應,所以幾乎沒有噪音的問題。
➤環境污染低:燃料電池使用氫氣與氧氣反應產生水,反應後排放的氮化物或硫化物極少,幾乎沒有任何污染,雖然目前氫氣最大的來源仍然是由輕油裂解工廠進行原油裂解反應產生,但是這種方法產生的二氧化碳比傳統內燃機所產生的二氧化碳減少 40% 以上。
➤燃料種類多:傳統的火力發電或內燃機必須使用煤、石油、天然氣等石化燃料,而核能只能使用具有放射性的鈾 -235,太陽能的能量轉換效率又很低,只有燃料電池可以使用所有含氫的物質做為燃料,包括:氫氣、酒精(可以由植物提煉)、甲醇、沼氣(可以由動物廢棄物提煉)、天然氣等,選擇很多。
➤應用範圍廣:燃料電池可以將許多單電池串聯起來得到很高的電壓與功率,可以廣泛地應用在各種手持式元件、車輛電力、分散型發電機、發電廠等。
❐ 燃料電池的缺點
➤陽極與陰極金屬觸媒價格高:目前燃料電池所使用的陽極與陰極金屬觸媒大部分都含有貴重或稀有金屬,所以價格很高。
➤質子交換膜專利費用高:目前質子交換膜的專利權掌握在少數公司手中,所以專利費用很高,造成燃料電池難以普及。
➤儲氫合金價格不低:如果陽極通入氫氣做為燃料,則必須使用儲氫合金,但是儲氫合金大部分都含有貴重或稀有金屬,所以價格不低。
➤使用含有氫原子的燃料效率不高:如果陽極通入含有氫原子的燃料(例如:甲醇),則必須先將甲醇(CH3OH)經由觸媒的改質反應形成氫氣,才能流入陽極,但是觸媒的改質反應通常只能將少量的甲醇轉換成氫氣(通常低於 12%),所以效率不高,而且觸媒通常含有貴重或稀有金屬,所以價格不低。
【請注意】上述內容經過適當簡化以適合大眾閱讀,與產業現狀可能會有差異,若您是這個領域的專家想要提供意見,請自行聯絡作者;若有產業與技術問題請參與社群討論。
《知識力》授權轉載
【延伸閱讀】


















