Gilead 成立於 1987 年,至今剛好 30 年,目前數個重磅炸彈藥物在手,在製藥界也算是年輕有為,但近 2 年 C 型肝炎市場的急劇萎縮讓其似乎陷入了“中年危機”,本文在此對 Gilead 的產品線和現狀做一梳理。
從 HIV/AIDS 起跑
Gilead 成立之初便以抗 HIV-1 感染藥物為核心業務,在 1996 年上市了 Vistide (西多福韋) 注射劑用於愛滋病患者的鉅細胞病毒視網膜炎,可謂是開發愛滋病藥物的先驅。
Gilead 在 2001 年上市了自家首個用於治療愛滋病感染的藥物 Viread (替諾福韋) ,在此基礎上,其愛滋病藥物管線已經壯大到如今的 10 個產品。
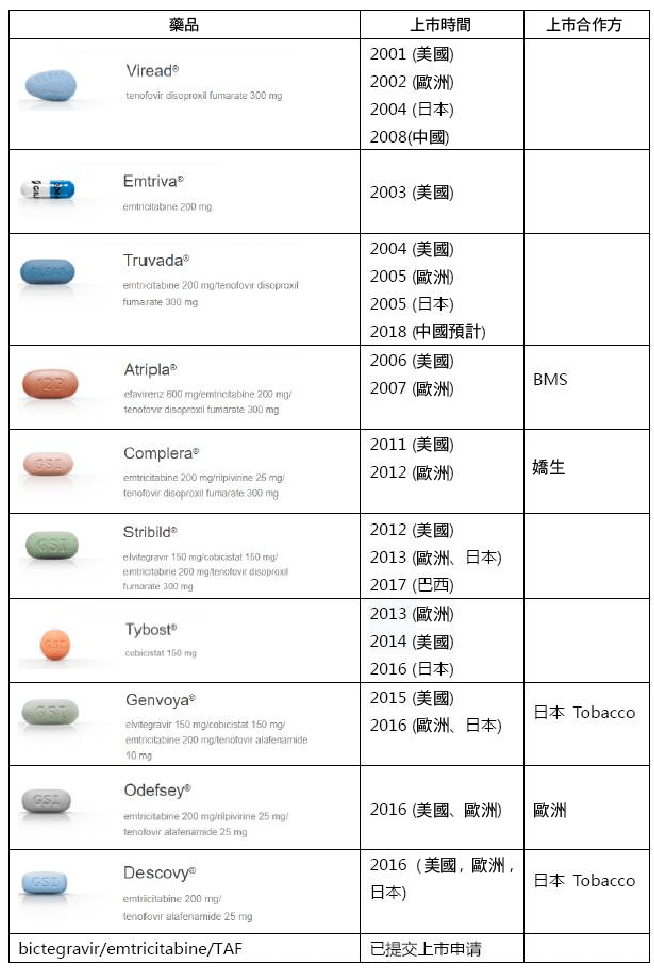
(Gilead 的愛滋病藥物產品線 來源:Gilead 官網)
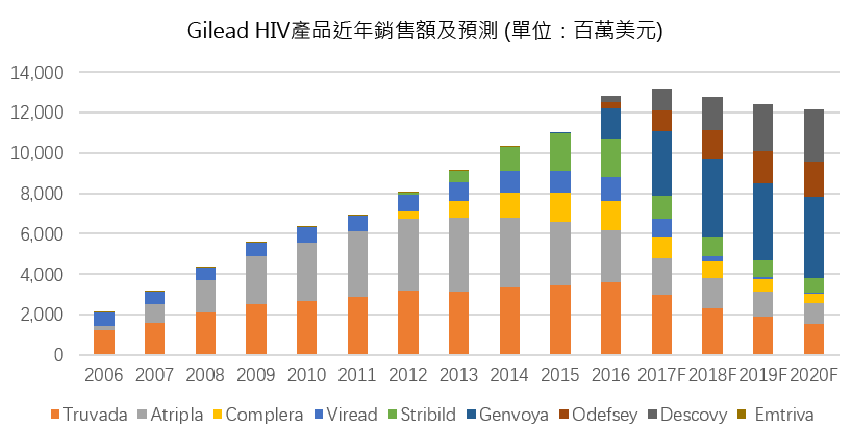
(來源:Globaldata)
Gilead 開發愛滋病藥物採用的基本都是 FDC (複方單片) 策略,在方便患者服藥的同時,還能享有相比單方用藥的溢價優勢。
2004 年,Gilead 推出了首個 FDC 愛滋病藥物 Truvada (恩曲他濱/替諾福韋) ,也為後續上市的基於核苷酸類轉錄酶抑制劑 (NRTI ) 的藥物組合 Atripla 、Complera 打造了核心骨。
現今, Gilead 在美國和歐洲市場主推 2015-2016 年上市的 Odefsey、Genvoya 和 Descovy,使其愛滋病業務市場份額突破 100 億美元,目前這三個藥物的市場份額也還在快速成長,不過 Gilead 想要保持 HIV 霸主地位,還是要克服不少挑戰:
生物相似藥: Atripla 的相似藥 2013 年進入歐洲,2015 年進入美國市場,導致 Atripla 的銷量迅速減少。
GSK 的競爭:GSK 旗下 ViiV Healthcare 推出了dolutegravir (整合酶鏈轉移抑制劑) 之後,GSK 有了在愛滋病市場與 Gilead 重新一較高下的資本,特別是 ViiV Healthcare 的最新組合 dolutegravir/rilpivirine 將在今年提交上市申請。因此, Gilead 在今年 6 月 12 日向 FDA 提交 bictegravir/FTC/TAF 的上市申請時,不惜動用了一張優先審評券。
HCV 治療格局改變者
做抗病毒藥物起家的 Gilead 原本從未涉足 HCV 領域,直到 2011 年花 110 億美元收購 Pharmasset,成為其進入 C 型肝炎藥物市場的一個跳板。Sofosbuvir 誕生後更是憑一手之力讓 Gilead 的年收入突破 300 億美元,幫助 Gilead 躋身全球十大藥廠之列。
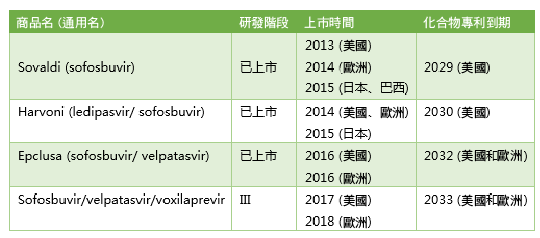
(Gilead C 型肝炎藥物產品線)
Gilead 每一個 C 型肝炎產品的上市都為 HCV 的治療都帶來革新性的變化:
- Sovaldi的上市:索非布韋+利巴韋林治療基因 2/3 型 HCV 感染,索非布韋+利巴韋林+長效干擾素治療基因 1 型 HCV 感染,首次為部分 C 型肝炎患者提供了一種全口服的藥物治療方案,而且治癒率高,安全性也顯著優於原有的治療方案。
- Harvoni 的上市:將愛滋病藥物 FDC 的開發策略用於 C 型肝炎藥物,為人數更多的基因 1 型 HCV 患者提供了純口服的治療方案,且治癒率超過 90%。
- Epclusa 的上市:通殺所有基因 1~6 型 HCV 感染的 C 型肝炎患者。
- Vosevi 的上市:通殺所有基因 1~6 型 HCV 感染的 C 型肝炎患者,甚至包括之前使用索非布韋單藥治療失敗的患者。
相比在美國和歐的快速成功, Gilead 在日本和中國市場的開發速度不如競爭者楊森和 BMS,楊森 Sovriad 是 2013 年 9 月率先在日本上市的下一代 DAA 藥物,BMS 的 Daklinza 和 Sunvepra 也於 2014 年在日本上市,Sovaldi 和 Harvoni 直到在 2015 年 3 月和 7 月才分別在日本獲批,但後勁十足,在日本上市的第 1 年內均進入日本藥物銷售額前 20,並前所未有的佔據 3.9% 的日本處方藥市場銷售額。
BMS 的達拉他韋 (Daclatasvir,DCV) 和阿舒瑞韋軟膠囊 (Asunaprevir,ASV) 2016 年已在中國率先上市,但 Sovaldi 在中國獲批在即,市場表現還是很值得期待的。
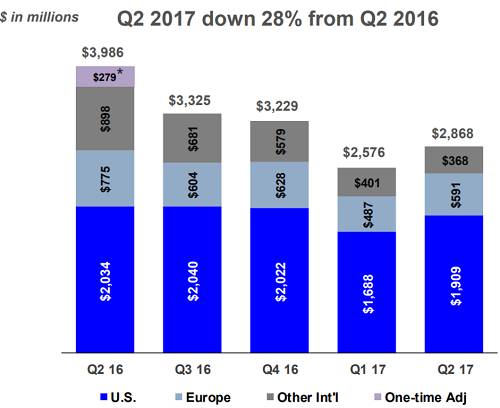
(Gilead C 型肝炎產品季度銷售情況 來源:第二季度財報)
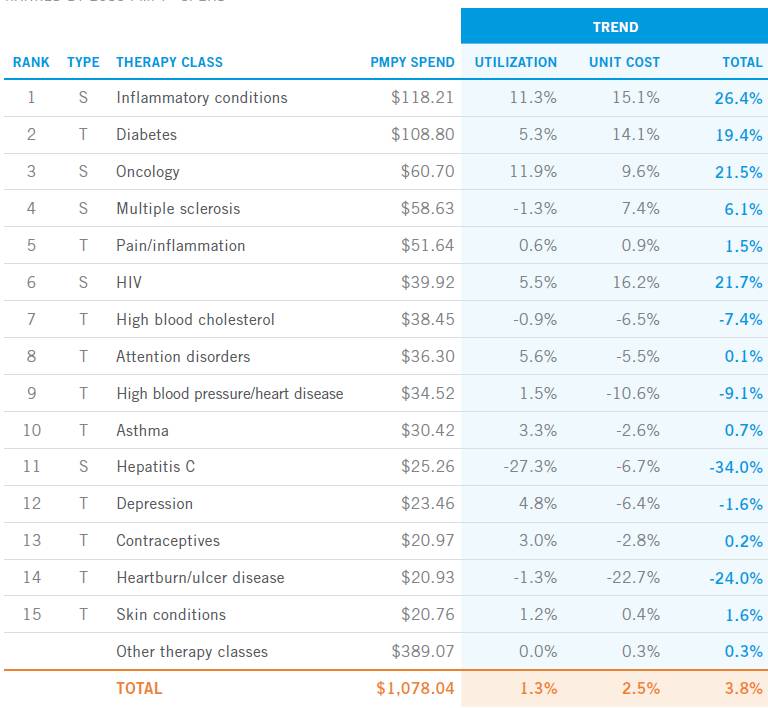
(2016 年各類適應症用藥趨勢 來源:express scripts 2016)
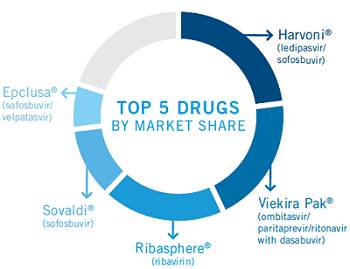
(來源:express scripts 2016)
Gilead 在 C 型肝炎藥市場仍然擁有巨大的優勢,但激烈市場競爭和患者的減少讓整個 C 型肝炎市場不可避免地萎縮。不過肝病仍是 Gilead 藥物開發的中心, Gilead 目前主要是把精力放在非酒精性脂肪性肝炎和乙肝的藥物研發上。
非酒精性脂肪性肝炎
Selonsertib 目標人群是重度 NASH 患者,伴有肝纖維化階段 F3 和 F4,目前正在進行 III 期試驗 (STELLAR 3 and STELLAR 4)並預計 2020 年 1 月完成。伴有肝纖維化的 NASH 患者具有高度未滿足性,但人群數目小屬於利基市場,若能順利完成試驗,也有助於之後擴展適應症用於抗肝纖維化的合併用藥。
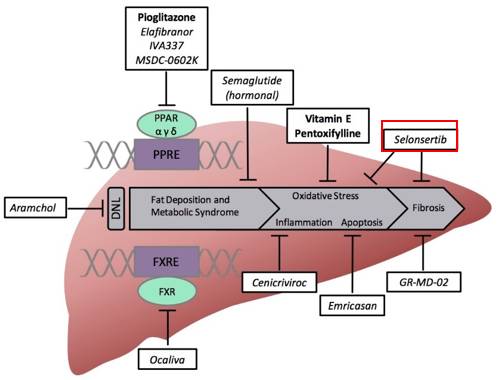
HBV 研發管線
管線中處於臨床 II 期的 GS 9620 是口服的 TLR7 激動劑。這類藥物可以增強對病毒特異的免疫反應,起到長久的疾病控制功效,也能被用於治療其他病毒感染。Gilead 還與 Spring Bank Pharmaceuticals 進行合作,SB9200 是該公司開發的單藥或聯合治療乙型肝炎和其他病毒性疾病的新型小分子核酸雜交 (SMNH) 複合物。
早在 2015 年就開始 Viread (替諾福韋酯) +SB9200 用於乙肝患者,2017 年 7 月 10 日又簽訂新的合作協議開始 Vemlidy (替諾福韋甲醯胺)+SB9200 用於乙肝患者 II 期臨床試驗。
血液腫瘤
Gilead 還通過 PI3K 抑制劑 Zydelig (idelalisib) 進入血液腫瘤領域,EvaluatePharma 曾預測 Zydelig 將在 2020 年達到其峰值銷售 120 億美元,但 2016 年臨床試驗中突然出現的幾次嚴重致死不良反應讓 Gilead 終止了對 idelalisib 的研發投入。Zydelig 目前仍留在市場上,但在 BTK、CAR-T 的耀眼光環輝映下市場前景基本上是一片黯淡。
現金充裕的財政狀況
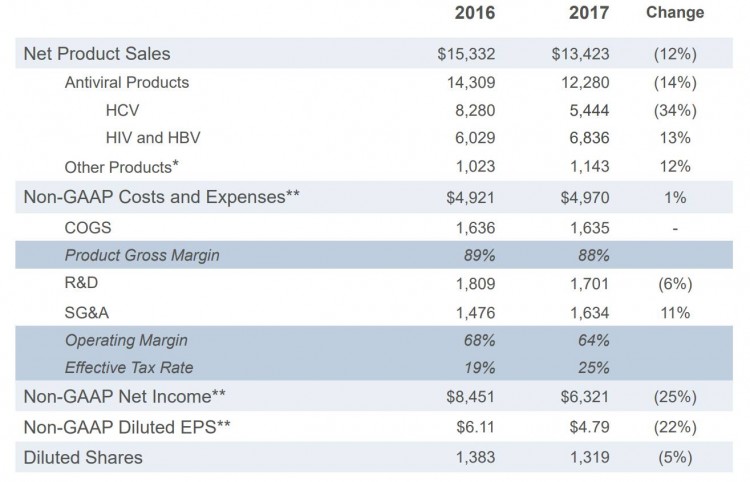
Gilead 第一季度財報中顯示,年度總體收入有所下降,HCV 產品下滑 34%,但 HIV 和 HBV 產品仍在穩步成長,研發費用降低 6%,與銷售管理費用 SG&A expenses 增加的 11% 持平。有傳言 Gilead 會有興趣收購 Intercept Pharmaceuticals 以擴張 NASH 管線。
Gilead 的中國征程
Gilead 進入中國的時間相對較晚,直至 2008 年 Viread 通過進口註冊並被批准用於 HIV。2007 年的國家愛滋病治療手冊裡 TDF 還屬於二線用藥,但之後修改的手冊至最新 2016 年第 4 版,全列為一線用藥,且國家免費提供。而後 Viread 在 2013 年被批准用於 HBV 治療並由 GSK 作為商業夥伴推廣。

2016 年 Gilead 聘任前羅氏製藥負責市場準入、商務和大客戶管理的副總裁羅永慶 (RogersLuo) 擔任全球副總裁和中國區總經理職務
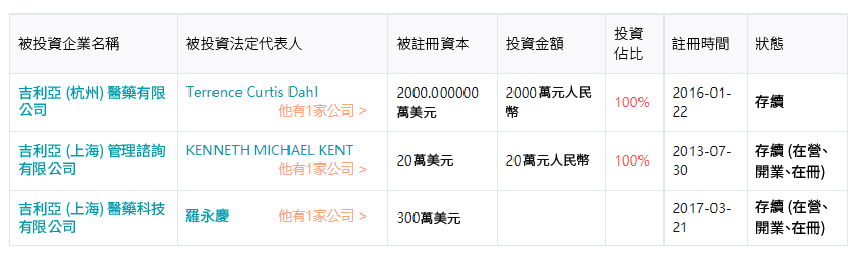
2017年在中國正式成立實體營運公司,三個註冊公司各司其職:
- 吉立亞 (上海) 管理諮詢有限公司 主要負責企業管理、貿易訊息、商務、國際經濟訊息諮詢 (涉及行政許可的憑許可證經營) 、市場行銷策劃 (廣告除外) 。
- 吉立亞 (杭州) 醫藥有限公司主要負責生產、分裝、銷售:藥品 (口服固體製劑) (除中藥及中藥飲片) ;以委託生產方式生產原料藥和藥品 (口服固體製劑) (除中藥及中藥飲片) ,銷售和出口。
- Gilead (上海) 醫藥科技有限公司主要負責醫藥產品的技術開發、自有技術成果轉讓,及相關技術服務和技術諮詢;企業管理諮詢、醫藥訊息諮詢 (不得從事診療活動,涉及許可證的除外) 、市場行銷策劃 (廣告除外) 。
儘管這兩年 C 型肝炎市場隨著 HCV 患者的逐步治癒而逐漸萎縮,為 Gilead 的收益蒙上一些陰影,但 Gilead 在今年 Q2 下滑的幅度低於預期,緩解了投資人的一部分擔憂,似乎最壞的時期已經慢慢走遠。
放眼未來,HIV 管線產品的穩步成長、NASH 產品可能帶來十億美金的銷量,血液腫瘤和免疫炎症等在研產品的進一步發展,有充裕現金去併購一些中小型藥企以擴張管線……這些都是讓 Gilead 走出“中年危機”的主要動力。30 歲的 Gilead 已經取得了令人矚目的成就,期待下一個 30 年。
《雪球》授權轉載
【延伸閱讀】