安成藥(4180)用於治療帶狀皰疹後神經痛的Lidoderm學名藥今年上市無望,恐延至明年初,而治療AIDS患者厭食症的Megace ES學名藥也延至第三季後上市。先前法人多預期安成今年每股盈餘將挑戰5元,甚至8元,預期在產品延後上市,今年難轉盈的不利訊息下,安成今日股價將難逃修正命運。
2015/04/17 08:15 財訊快報 何美如
安成國際藥業是一家專注於開發特殊學名藥的領導廠商,擅長於開發具有高度進入障礙的特殊學名藥。這條路原本就困難重重,但安成藥多年來在此領域深耕已久,也有多個循著P4路徑的成功案例,那到底什麼是P4?安成藥的機會又在哪呢?就讓我們用其中一個P4候選藥物一起來看看吧。
資料來源:安成藥官網
台灣學名藥廠 – 安成藥業 (TWi) 在今年1月中的新聞標題就是遭原廠Supernus Pharma (SUPN)在美國紐澤西地方法院,對抗癲癇藥品Oxtellar XR的學名藥申請案提出專利侵權訴訟。
對於遭原廠訴訟的麻煩處境,安成藥在1月22日也公告指出:『公司於日前向美國FDA提出產品Oxtellar XR的學名藥申請案,並對橘皮書中的專利提出paragraph IV聲明。Supernus Pharmaceuticals, Inc.為Oxtellar XR 的藥證與專利所有權人。此專利侵權訴訟屬於法規程序,因產品尚未上市,故無侵權賠償問題』。但是這個聲明稿似乎有點咬文嚼字,Oxtellar XR是哪種藥?市場多大?據瞭解應該還在專利期啊?橘皮書是甚麼?paragraph IV聲明又是甚麼?疑惑的點太多了,以下就幫大家好好的分析一下。
先來好好認識一下這次新聞事件的主角:Oxtellar XR,一個口服錠劑,服用進身體後會慢慢釋出藥品的有效劑量,持續穩定的維持藥品療效,不同於大部分立即釋放的藥品,這屬於緩慢釋放的特殊劑型設計。服用方法為一天只需使用一次,是局部癲癇 (俗稱:抽筋) 治療的輔助性療法。此藥品通過完善的臨床試驗後除證明可使用於成人病患外,美國FDA另許可可使用於6-17歲兒童。根據IMS Health的資料顯示,該藥品一年於美國市場規模約為1900萬美元。
根據Supernus Pharma的說法,Oxtellar XR的專利保護期應該在2027年才到期,而安成藥意圖在產品專利到期前即申請學名藥上市,屬於侵犯原廠專利,因此提出告訴。而法人表示,到目前為止挑戰原廠專利的只有安成藥一家。
神秘的橘皮書,內藏關鍵paragraph IV – 專利藥廠不再享有獨家優惠
橘皮書是甚麼?paragraph IV聲明又是甚麼?為什麼可以讓擁有獨家銷售權的製藥大廠Supernus Pharma緊張的提出專利侵權訴訟?這一切要從1984年Hatch-Waxman (HWA)法案說起。
先進國家由於人口老化、醫療發達,通常會面臨重大的財務困境。政府是兩難的,一方面要鼓勵醫藥產業的發展以維護國人健康,另一方面也要同時改善高昂的原廠專利藥價格對於醫療保險和民眾財務負擔太重的情形。美國國會在1984年通過了Hatch-Waxman (HWA)法案,又稱為「藥品價格競爭與專利期補償法」,設計了一套復雜的遊戲規則,在鼓勵新藥開發的同時,也促進了學名藥產業的發展及藥價的競爭,貢獻非常的大!。
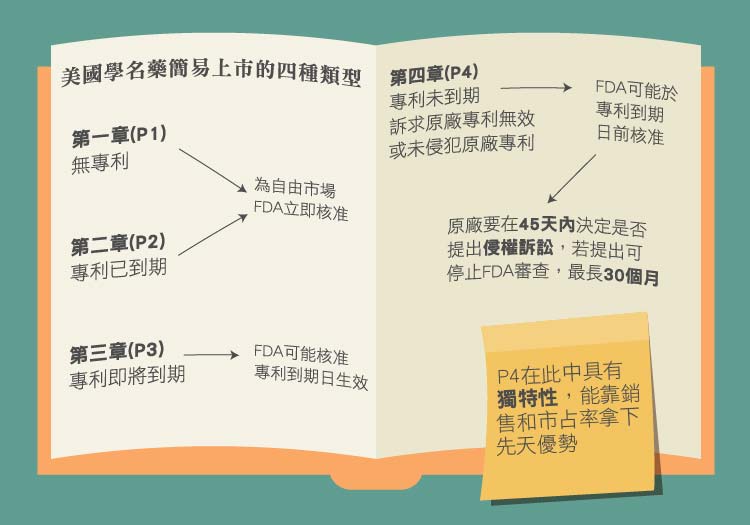
HWA法案規定專利藥廠在申請新藥查驗登記時,必須向FDA提出與申請上市有關的專利資訊,FDA會將此登載於一般慣稱的「橘皮書」(Orange Book)中,而在這本書中總共有四個章節在討論相關的專利問題,分別為Paragraph I~IV (簡稱:P1 ~ 4,第一章至第四章)。
其中的第一至三章為無專利問題或專利到期日之後,FDA才會允許生效,進入門檻較低,是大多數學名藥廠採用的申請方式。比較特別的是 Paragraph 4,FDA可能在專利到期日前就允許上市。第一家申請Paragraph IV簡易上市的廠商就具有第一申請 (first-to-file,FTF) 的資格,一旦申請上市取得成功,就有180天的「獨家銷售權」!在這180天當中,原廠專利藥物仍會繼續銷售,但具有FTF資格的學名藥則會成為市場中唯一的學名藥品。
由於第一個上市的學名藥價有較原廠藥便宜的優勢,往往在一個月內就可以取代原廠超過八成以上的市場,藥價也有70%以上,因此吸引了許多大型學名藥廠投入Paragraph IV的申請。
HWA法案當然不能如此偏袒學名藥業,因此另外規定了若是學名藥廠依循Paragraph IV向FDA提出藥證申請後,也必須知會原專利所有人,而原廠要在45天內決定是否提出侵權訴訟,這段期間FDA將暫停此藥證審件,靜待專利判決,但最長停止審查的時間不得超過30個月。
被告反而證明此學名藥具競爭潛力
由以上的說明應該可以了解安成藥與Supernus Pharma完全依據HWA訂出的遊戲規則:
- 安成藥利用Paragraph IV在專利保護期間申請學名藥上市
- Supernus Pharma運用HWA法案給予的防護盾牌提出侵權訴訟,策略是要阻止此學名藥提早進入市場,意圖爭取30個月的保護期。
從另一方面想,安成藥『被告』反而證明了它的學名藥品具有競爭力,經由Paragraph IV 而通過簡易學名藥(ANDA)申請上市的機率很高,才會引得原廠趕快提出訴訟,以阻止此學名藥進入市場。
新藥開發難度高,製藥廠莫不紛紛尋求其他生路
話說回來,新藥開發不是應該才是製藥大廠的發展重點嗎?為什麼會有學名藥廠竟是以開發特殊學名藥為職志呢?
新藥開發有多難?開玩笑的說是『比登天還難』,要有充足的資金、時間、專業資源、還要有無比的運氣。成功研發上市一個新藥需要先經過大海撈針般的藥品篩選流程,再施行漫長的人體臨床試驗以確認安全與有效性,平均開發時間以十年起跳,花費金額通常在三億美元以上的天價,而完成整個新藥上市流程的成功機率僅有0.02%~0.01%!因此好不容易開發成功的『原廠藥』(又稱:專利藥) 銷售價格是必須負擔藥廠的研發成本,毛利率高達9成以上。
新藥開發是典型的高風險高報酬的夢想產業,因此許多製藥廠商轉而選擇生產風險較低的『學名藥』(又名非專利藥,為證明與原廠藥同成分、同效果的藥品,通常在原廠專利過期後可允許上市)。但就因為學名藥產業進入門檻低,價格競爭激烈,利潤也較低。要在學名藥產業賺到錢,就要有獨特性!靠銷售和市占率拿下先天優勢,Paragraph IV就是其中一種手段,安成藥總經理陳志光就曾表示,相較於新藥不及1%的成功率,挑戰P4藥品成功上市的機率約有5成!

要挑戰Paragraph IV雖然不可避免會與原廠進行難纏的侵權訴訟,其費用就佔研發的一半之多,但市場規模卻是普通學名藥廠的40倍!這樣一解釋就不難想見有實力的學名藥廠必然會走這種生產模式。搶Paragraph IV的學名藥廠必須擁有深厚的實力,對FDA的規範及專利訴訟有一定的瞭解度,選擇的藥品大多具有高市場價值或是特殊使用族群,要有獨到的眼光且申請動作必須要『快』!
全球面臨人口結構的改變,高齡人口以空前的速度攀升,在2014年全球醫療支出達到1兆美元,預估在2017年將達到1.2兆美元!這証明了藥品的需求將會日益增加。新藥開發的高難度使大藥廠必須得朝學名藥產業邁進,在爭食的學名藥市場中脫穎而出的關鍵必然是『獨特性』。安成藥此次是否仍能順利搶關成功,端看其實力堅強與否。



















訂閱制後的營收變化_.png)


