今天,要講一講 Dynavax 公司 (納斯達克股票代碼:DVAX) ,一家研發乙肝疫苗和免疫類藥物的公司。熟悉醫藥股的朋友肯定知道,Dynavax 公司最核心的產品是新型乙肝疫苗 Heplisav ,已經數次提交 FDA ,每次都因為種種原因被 FDA 否定。7 月 28 日, FDA 諮詢委員會就 Heplisav 安全性進行投票,投票結果 11 比 1 支持。8 月 10 日, FDA 將公佈最終的審評結果。
筆者曾經講過這個股票風險極大,普通投資人最好不要碰,即使有了今天這樣的投票結果, Dynavax 公司股票肯定會有一輪大漲,我的觀點也不會改變。書呆老李就梳理一下 Heplisav 乙肝疫苗的審批歷程,以及 Dynavax 公司和 FDA 十年間的鬥爭。
Heplisav 乙肝疫苗的機制
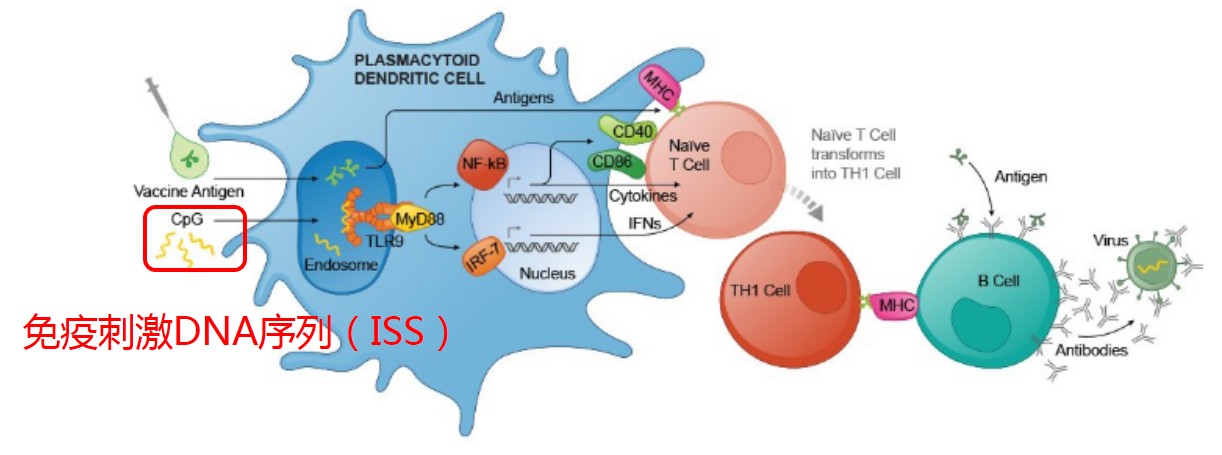
Heplisav 乙肝疫苗是在普通疫苗裡加入 Dynavax 公司發明的免疫激活序列 DNA 序列 ISS (immunostimulatory sequence) ,該技術建立在 2011 年諾貝爾獎基礎上,不僅放大免疫信號,而且讓免疫反應更有針對性。
Dynavax 公司開發的所有產品都基於這個思路,區別在於:有的產品基於免疫激發序列 DNA 序列;有的產品基於免疫激發序列 RNA 序列。
如果 Heplisav 乙肝疫苗獲得 FDA 批准,證明 ISS 這個研發思路是可行的。理論上講,所有涉及免疫的藥物都可以使用這種技術。這樣就和如今熱門的腫瘤免疫治療沾上邊,又有了大家熱烈討論的 SD-101 。關於 SD-101 ,以後有機會詳細說,本文主要還是關注 Heplisav 乙肝疫苗。
Heplisav 乙肝疫苗的療效
Heplisav 乙肝疫苗的療效毋庸置疑。Dynavax 公司在過去 16 年裡做了 14 個臨床實驗,1 萬多病例,所有對照實驗中,Heplisav 完勝普通疫苗,無一例外。
- 普通疫苗要打半年或一年,Heplisav 只需 1 個月;
- 普通疫苗要打 3 針或 4 針,Heplisav 只需 2 針;
- 普通疫苗對慢性腎病病人要打 8 針,Heplisav 只需 3 針;
- 普通疫苗效果不佳的病人 (需要透析的患者、患有二型糖尿病的患者) , Heplisav 依然有良好的藥效。
其實, Heplisav 乙肝疫苗被 FDA 反覆否定多年,給出的理由都是安全性問題。
Heplisav 乙肝疫苗嚴重的不良反應事件
2008 年,Dynavax 公司對 Heplisav 乙肝疫苗正在進行 3 個三期臨床試驗,分別針對 18 到 70 歲的成年人、40 歲以上的成年人和慢性腎病患者。(註:40 歲以上的成年人和慢性腎病患者對普通疫苗效果不佳。)
在美國境外進行的三期臨床研究中,接受 Heplisav 乙肝疫苗的一個受試者發生了嚴重的不良反應事件,該受試者被診斷患有韋格納肉芽腫病,一種血管發炎的罕見疾病。 FDA 因此中止了 Heplisav 乙肝疫苗所有臨床試驗,Dynavax 公司的股價也從 50 多美元跌到不到 3 美金。
其實, Heplisav 乙肝疫苗完成了 1 萬多例的臨床試驗,其中包括一個 8000 多患者的大型安全性臨床試驗,嚴重不良反應只有這一例。
另外,這例嚴重不良反應的原因,到今天也沒有明確的說法。這例嚴重的不良反應事件成為 Heplisav 乙肝疫苗永遠擺脫不掉的噩夢,每次 FDA 進行審評,都被人拿出來討論。
嚴重的不良反應事件的解決
2009 年,經過 Dynavax 公司反覆申訴,Heplisav 乙肝疫苗針對 40 歲以上的成年人和慢性腎病患者三期臨床試驗得以繼續。大家漸漸把這件事淡忘,公司股價也慢慢恢復正常。其實,這件事遠沒有解決,也就有了 Heplisav 第一次被 FDA 拒絶批准。
Heplisav 第一次被 FDA 拒絶
2011 年, Dynavax 公司完成 Heplisav 乙肝疫苗針對 40 歲以上的成年人和慢性腎病患者三期臨床試驗,向 FDA 提出 BLA 申請。
正式向 FDA 提出 BLA 申請前, Dynavax 公司和 FDA 做了一些溝通,提出 Heplisav 乙肝疫苗適應人群為 40 歲以上的成年人和慢性腎病患者。FDA 認為 Dynavax 公司太過保守,建議以 18 到 70 歲的成年人為適應人群申請 BLA,申請獲得批准後,再拓展適應人群到慢性腎病患者。
Dynavax 公司花費兩個月時間,重新撰寫了申報資料,提交 BLA 申請。 FDA 諮詢委員會對 Heplisav 乙肝疫苗投票,療效 13 比 1 支持,安全性 8 比 5 反對 (一票棄權) ,理由是 Dynavax 公司不能證明 Heplisav 乙肝疫苗在 18 到 70 歲人群中的安全性,還有就是那例嚴重不良反應事件。
看到這裡,大家是不是能明顯感覺到 FDA 對 Dynavax 公司的惡意。
Heplisav 第二次被 FDA 拒絶
Dynavax 公司吸取教訓,重新針對 40 歲以上的成年人和慢性腎病患者提出申請。 FDA 給出的審評意見也算奇葩:療效強烈認可;限制使用範圍可能限制受益人群,對患者不利;即使限制使用,安全性數據也不充足。
FDA 給出的最終結論是:補充安全性數據,繼續申請 18-70 歲患者。
Heplisav 乙肝疫苗大規模安全性臨床試驗
Dynavax 公司也只能認下這個結果,開啟了一個 8000 多人的三期安全性臨床試驗。試驗結果顯示:療效上完勝常規疫苗;沒有任何安全性問題。
Heplisav 第三次被 FDA 拒絶
2016 年,完成大規模安全性臨床試驗後, Dynavax 公司向 FDA 提出 BLA 申請。本來已經定好 PDUFA 日期, FDA 先是推遲 PDUFA 三個月,之後直接取消詢委員會審議 Heplisav 乙肝疫苗的 BLA。
FDA 直接給出審評意見:重新提交申請,6 個月後給出審評意見。給出的理由是: FDA 沒有完成不良反應資料的審核;心臟不良反應數值失衡。
心臟不良反應數值失衡指的是:常規疫苗組,心臟不良反應發生率出人意料的低,也就是說, Heplisav 乙肝疫苗沒有什麼心臟安全性問題。個人感覺, FDA 純屬刁難。
重新提交申請
閲讀 Dynavax 公司的 Press Releases 時,我感覺 Dynavax 公司對重新提交申請也有些絶望,進行了裁員,將研發重點放在 SD-101 ,甚至停止了 Heplisav 的生產。絶望歸絶望,申請還是要重新提交的。
Heplisav 乙肝疫苗的療效確實沒話說, FDA 也認為療效無需投票,諮詢委員會僅對安全性投票。也就有了文章開頭 11 比 1 支持的投票結果。
看到這裡,大家是不是也鬆口氣,感覺 Heplisav 馬上就要獲得批准。
諮詢委員會的投票結果和 FDA 最終的審評結果
一般來說,諮詢委員會的投票結果和 FDA 最終的審評結果是一致的。最近幾年, FDA 越來越不重視諮詢委員會的投票結果,大概有 10% 的情況結論不一致。 FDA 和諮詢委員會觀點發生分歧,通常是諮詢委員會否定新藥, FDA 選擇通過。 Heplisav 乙肝疫苗最終的命運在今年 8 月10日分曉。
寫到這裡,總結一句: Heplisav 乙肝疫苗確實是一個好藥; Dynavax 公司和 FDA 到底有什麼恩怨,我也不清楚。不過預測它的審評結果基本上不可能,作為一個普通投資人,還是安安靜靜的看戲就好。
《雪球》授權轉載
【延伸閱讀】