2023 年前副總統陳建仁上任成為新任的行政院院長,由於其過去在生技產業富有資深經歷且曾任中研院院長,因此許多市場法人都看好 2023 年為「生技元年」。最近有許多生技類股都有潛在利多題材待發酵,而其中最重要的就是在 2021 年底通過的「再生醫療三法」,這將影響到整個新興醫療技術的發展。下文就讓我們帶大家了解再生醫療是甚麼吧!
編按(2024/6/5 更新):
歷經十年的努力,《再生醫療法》及《再生醫療製劑條例》(合稱再生醫療雙法)終於在 2024 年 6 月 4 日三讀通過,放寬再生醫療的限制,新法賦予再生醫療研究發展、技術管理、細胞源頭管等法源依據,為台灣生技產業寫下嶄新一頁。三讀通過後的四項重點包含研究發展促進再生醫療、再生技術管理、細胞源頭管理,以及加重非醫療機構執行再生醫療罰則。且為鼓勵國內業者投入再生醫療研究發展,條文明定中央主管機關或中央目的事業主管機關得就再生醫療的研究發展,給予獎勵或補助,並另訂定獎勵辦法。
此次再生醫療雙法三讀通過的好消息讓生技產業及器材產業大幅受惠,生技業前景樂觀,三讀通過隔天訊聯(1784)早盤大漲5%、長聖(6712)漲3%、三顧(3224)漲2%;進階(3118)午盤時也大漲逾5%。
再生醫療是什麼?
再生醫療就是把你原有的好細胞拿來修復、取代因疾病傷痛等因素受損的壞細胞、器官。我們過往傳統的醫學治療方式都是透過藥物、手術治療,最終結果可能是延緩或改善部分病症,或直接將受損部位切除,達到不可逆的負面結果;然而再生醫療是利用細胞重組的方式,將受損的器官或部位重組,解決許多過往可能被視為絕症的重大傷病。
根據 GMI 研調機構預估,全球的再生醫療市場將會在 2027 年達到 1,000 億美元以上,以 19% 的 CAGR 持續成長,主要就是受益於幹細胞療法、細胞儲存等技術愈加成熟所致。
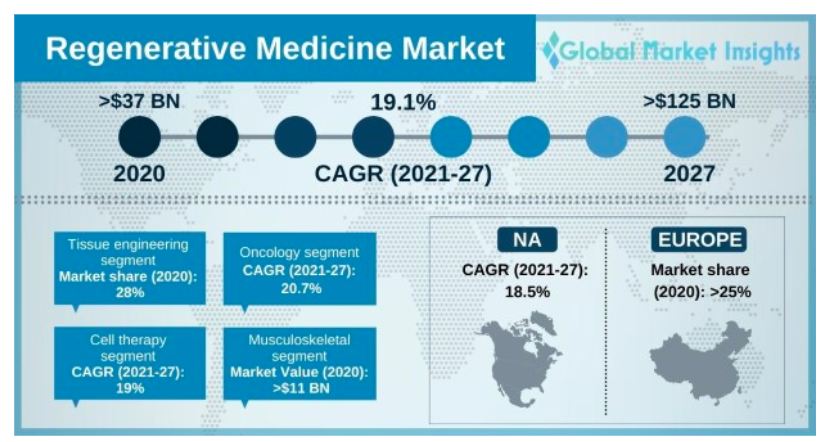
▲圖片來源:Global market insight
再生醫療產業鍊
再生醫療產業鏈上、中、下游分別為幹細胞的儲存、開發、及實際技術應用。上游的幹細胞儲存涵蓋範圍相當廣,包括新生兒臍帶血、受精卵、骨髓、細胞、皮膚等領域。例如近幾年女性工作結構改變,許多婦女都會選擇在年輕時衝事業,然後透過「凍卵」的方式讓自己不會錯過最佳的生育期,保有良好的生育力,這就是目前十分流行的運用案例之一。而幹細胞部分則主要是透過臍帶、臍帶血的方式取得。若要儲存自體幹細胞時可以檢查該機構有沒有通過各地法規、第三方認證來選擇適合自己的「幹細胞銀行」。
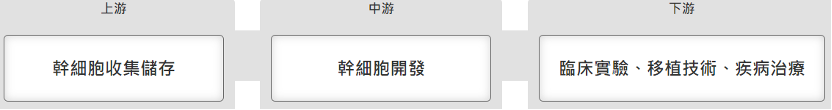
▲圖片來源:產業價值鏈資訊平台
中游部分則是幹細胞的開發,透過配對上游的臍帶血、臍帶、牙幹細胞等,鑽研其中的解凍技術及幹細胞移植的技術,確保上游的幹細胞在轉化過程中能夠符合患者所需。而目前主流的應用主要有臍帶血、羊膜胎盤、成人周邊血等,應用於血液相關疾病治療及皮膚相關疾病重建。
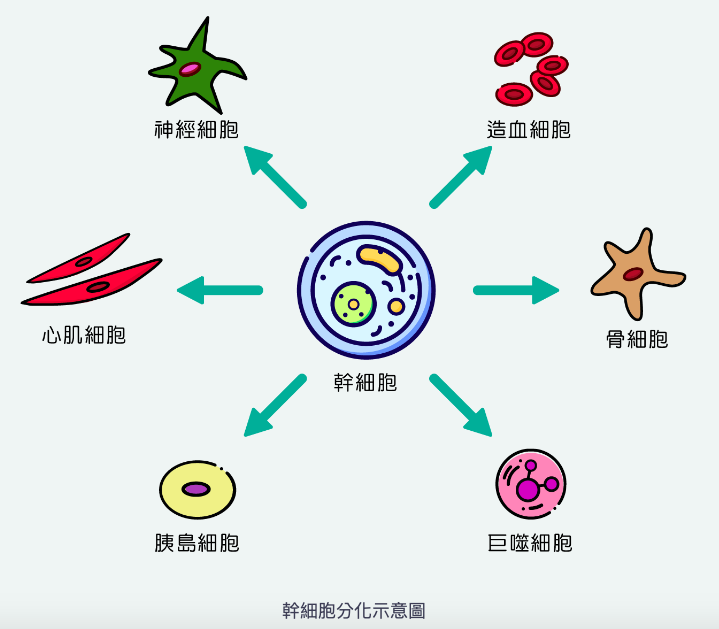
▲圖片來源:豐沛生醫
下游部分是從事幹細胞相關的臨床實驗、技術開發。隨著幹細胞治療技術愈來愈成熟,生技業者及研究機構逐漸將研究方向從原先的血液相關治療拓展到許多其他不同的病症。包括癌症免疫療法、治療遺傳性疾病及心肌疾病等,目前許多都已經進入到臨床實驗的階段,而未來能否拓展更多應用,就是倚靠這些研究機構的研究成果作為標竿。
再生醫療概念股
台灣針對再生醫療領域有不少相關的概念股,但許多是屬於興櫃領域的(如 4186 尖端醫、 6794 向榮生技、 6838 台新藥、 6891 樂迦再生、 6892 台寶生醫等),短期漲跌幅度驚人且流動性較少,容易受到相關題材炒作後又崩跌,主要是特定人在操作。興櫃股票較少公開資訊,若要了解各自研發的細項內容可以再參考公司的官網及拜訪公司。以下先用簡單的表格比較一下,後面有各自詳細的介紹:
| 股票代號 | 6712 長聖 |
6461 益得 |
1784 訊聯 |
6550 北極星藥業 |
| 產業鍊 | 上中游 | 上中游 | 上中游 |
下游 |
| 背後大股東 | 晟德(上市) 安基生醫 |
健喬(上市) | 坤倫投資 (投資公司) |
Digital Capital (投資公司) |
| 業務題材 | 幹細胞新藥研究 幹細胞及免疫細胞療法 |
呼吸道 肺部疾病藥品研發 CDMO 藥物 |
基因檢測 幹細胞療法 CDMO 藥物 |
癌症相關藥物 CDMO 藥物 |
再生醫療上中游
6712 長聖、 6461 益德、 1784 訊聯
長聖 2021 年才掛牌上櫃,有新藥開發及細胞委託製造兩大業務。在技術方面目前以免疫細胞及幹細胞兩大技術平台,積極研發新興細胞療法,應用於癌症治療、白血病血癌研究,是全方位免疫細胞與幹細胞療法之新藥研發公司。新藥開發方面主要是臍帶幹細胞的相關療法,除了本身的技術外,有與中央研究院、交通大學與中國醫藥大學合作技術移轉,擁有多樣的細胞療法技術。
長聖 2024 年 5 月單月營收 6012 萬元,年增率11%,今年 1-5 月營收年增 27.3%,同步創下歷年同期新高。受惠於細胞委託製造(CDMO)合作醫院數量與合作細胞治療項目亦不斷擴大,訂單能見度已到明年第一季,今年第一季營收與獲利均較去年同期大幅成長,營業利益更成長3倍。
除了CDMO表現積極外,長聖也深耕布局新藥開發方面,已擁有免疫細胞技術平台、幹細胞技術平台與奈米粒子製藥三大核心平台,今年計劃開發外泌體的第四個新藥平台並建造第四座臨床等級的 GMP 再生醫療廠,以具有靶向的外泌體開發阿茲海默症和帕金森氏症等神經退化性疾病的創新外泌體藥物。
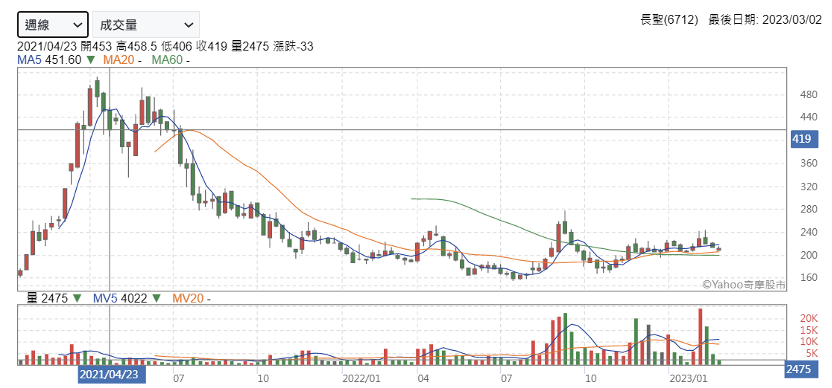
觀察到長聖股價部分在 2021 年剛 IPO 的時候有過一段驚人的漲幅,上櫃當天股價就漲了 2 成多, 2021 單單一年內股價就漲了快三倍卻又在下半年回到原點,有可能是當時受惠特管法剛過,細胞療法話題正夯所致。只能說研究生技股時比起了解財報數字,不如認真了解背後的技術或題材,甚至新藥解盲時間為何更重要。
▲圖片來源:奇摩股市
益得為健喬投資的子公司,,是亞洲最大的呼吸道相關藥廠,且同時是國內唯一擁有 HFA MDI(氫氟烷定量噴霧吸入劑)技術平台的生技公司。其開發的吸入式氣喘藥在 2022 年已通過台灣衛福部食藥署(TFDA)藥品許可證,提供氣喘與慢性肺阻塞病患治療使用,且獲得澳門上市許可,並已陸續向東協國家申請上市,進軍成長快速的東南亞。SYN011 為 Salbutamol 支氣管擴張劑,在 2023 年成功插旗加拿大,進軍北美市場。除了現有的呼吸道及肺部疾病相關研究外,益得還有與大陸的合作夥伴海思科(Cicso, CSCO-US)醫藥集團共同研發 CDMO 藥物。
益得已經完成 Duasma 臨床試驗,並於 2023 年 11 月向中國國家藥品監督管理局(NMPA)提出上市申請。從明年起,益得的對外佈局將持續開花結果,不僅在亞洲地區的中國大陸、東南亞,將陸續申請或取得上市許可,且對於市場最大的北美市場,也已經踏出第一步。益得將在技術開發與生產製造,持續深耕台灣,打造全台唯一呼吸道製劑專業藥廠,並積極進行全球布局,讓益得成為立足台灣,銷售全球市場的全方位吸入劑特色藥廠。
▲圖片來源:奇摩股市
訊聯是台灣國內第一家私營的臍帶血與幹細胞公司,並且擁有台灣最大的臍帶血儲存銀行,現今跨入再生醫療領域,透過整合「幹細胞治療」與「基因檢測」專攻皮膚相關幹細胞研究。旗下還有多間轉投資公司專攻醫美領域,推出自有品牌「訊聯生技 RE.O」,結合幹細胞療法達到針對個別基因最好的換膚模式。此外在公司官網還有放上寵物再生治療的案例!治療貓狗的退化性關節炎,算是醫療領域中涵蓋極廣的一間公司。
訊連的新藥開發加速,脂肪幹細胞獲准計畫案數占全台5成,外泌體耕耘也攻進醫美、皮膚、毛髮機構。日前臍帶間質幹細胞新藥 BU-01 治療肺部纖維化跨入人體臨床二期,治療急性呼吸窘迫症候群(ARDS)人體臨床二期收案近 50%;幹細胞來源的外泌體新藥 ExoTear 治療乾眼症,獲醫藥品查驗中心(CDE)指標案件輔導,加速新藥開發進程。
▲圖片來源:奇摩股市
再生醫療下游
6550 北極星藥業
北極星藥業專注於抗癌新藥研發,應用包括肝細胞癌、間皮瘤、胰臟癌、非小細胞肺癌、黑色素瘤以及急性骨髓性白血病等。其與全球頂尖的癌症中心合作執行臨床試驗,並在美國加州和中國成都建有 cGMP 藥廠。公司成長雙引擎包括抗癌新藥及去年底併購霖揚生技,跨入最夯的多胜肽產品。2024 年初買下竹南現成廠房,正做機器裝機,預計今年第 3 季末可試產,明年出貨。
雖然公司累計虧損高達新台幣百億元,但目前已有部分新藥提交美國 FDA 藥證申請,也與幾家國際藥廠談授權,著重在利益分享及通路銷售,未來授權金進來加上藥品上市後將有營業額,以及多胜肽針劑產品積極建立生產線,明年有望正式出貨,北極星對將來有信心,能夠彌補虧損。
▲圖片來源:奇摩股市
再生醫療應用
再生醫療目前主要有三大應用,各自對應不同類型的病症,實際案例如下:
- 器官修復:所有人都會老化、生病,此時器官可能就會有一定程度的退化、受損。幹細胞的治療可以刺激既有器官的自我修復,讓其能逆轉恢復到較為健康、年輕的狀態,這時候就不需要利用其他醫療器具的輔助維持器官運作功能。
- 免疫細胞療法:透過培養免疫細胞的增殖方式,強化人體自我的免疫系統,或是直接賦予相關免疫細胞到病患體中,協助治療癌症的疾病。不像傳統的化療、放射性治療會有許多衍生的副作用,且不需大量殺死其他既有的好細胞。
- 幹細胞療法:目前主流的醫療方式有幹細胞移植(應用患者或捐血者周邊的血液,臨床研究上可用於中風、肝硬化、阿茲海默症等)、骨髓移植、臍帶血移植(臍帶血中有豐富的造血幹細胞及自然殺手細胞(NK 細胞),可以用於治療血液疾病、免疫疾病、代謝疾病、惡性腫瘤等)
💡參考資料:超基因生技
台灣在過去受限於法規、臨床試驗結果的定義不夠明確,導致細胞療法較難蓬勃發展,但在國際併購趨勢興起、再生醫療逐漸變為顯學的狀況下,台灣也陸續通過幾個關鍵性法案,在近期朝向生技研發友善的政策邁進。
再生醫療未來展望
2022 年 2 月行政院正式通過「再生醫療雙法」,讓未來細胞療法相關的製劑能夠在第二期通過後就「有條件的」提早上市。這將直接縮短再生醫療研究開發的相關企業,讓他們的研發時間、成本都大幅度的縮短,加速技術的演進,同時也會刺激新興的開發廠商加入這個領域。對民眾而言,患者也會直接受益到相關療法的成本下滑,且能夠應用到更新的技術與醫療方式,促進其他周邊新藥的應用及開發。
全球針對再生醫療產業的看法都相當積極,例如歐美、日本都有人口高齡化的趨勢,使得慢性病、癌症等治療需求就擴大相當多,這時候再生醫療這種副作用相對降低許多的療法就會是最有吸引力的選擇。而美國也直接受益國家醫療保險計畫的涵蓋範圍擴大、政府及新創企業加大相關產業的投資,讓這個市場有高達近 20% 的CAGR。
再生醫療雙法完成三讀
歷經 10 年推動《再生醫療法》及《再生醫療製劑條例》(簡稱「再生醫療雙法」),2024 年 6 月 4 日終於在立法院三讀通過,後續將訂定相關子法等配套措施,力拚 2024 年底前報請行政院審議,希望 2025 年新法能順利上路。再生醫療雙法鬆綁再生醫療的限制,提供醫生及病人武器,對抗罕重症,也讓衛福部可以依法管理再生醫療產業,保障病人的權益,為台灣生技產業寫下嶄新一頁期,促進台灣經濟發展。
這次根據三讀通過條文明定:
- 非醫療機構不得執行再生醫療,且醫療機構執行再生技術前應進行並完成人體試驗,但有兩類特例情況可以免完成人體試驗,第一是治療危及生命或嚴重失能的疾病,且台灣尚無適當的藥品、醫療器材或醫療技術的緊急需求(恩慈治療),第二則是再生醫療法施行前,醫療機構經中央主管機關核准執行的再生技術。若因再生醫療執行影響病人生命、身體或健康甚鉅,除加重對非醫療機構執行再生醫療,或為再生醫療廣告處罰至最高新台幣2千萬元外,非醫療機構執行再生醫療,得沒入其相關設備及再生製劑。
- 恩慈治療的條件、申請、案例數限制、倫理規範,由中央主管機關公告,但治療應排除異種細胞、組織。
- 將現行「人類胚胎及胚胎幹細胞研究倫理政策指引」法制化。規範未來再生醫療研究涉及胚胎或胚胎幹細胞,不得以人工受精方式製造胚胎、不得製造雜交體、不得以其他物種細胞核植入去核的人類卵細胞、不得繁衍研究用胚胎、不得製造或繁衍具有人類生殖細胞的嵌合物種等。
- 為鼓勵國內業者投入再生醫療研究發展,條文明定中央主管機關或中央目的事業主管機關得就再生醫療的研究發展,給予獎勵或補助,並另訂定獎勵辦法。
- 明定藥商製造、輸入再生醫療製劑,應向中央主管機關申請查驗登記,並經核准發給發給藥商許可證,或核予有附款許可後,始得為之;且藥品許可證有效期間為五年,期滿仍需繼續製造、輸入者,應於有效期間屆滿三個月前至六個月間,申請核准展延,但每次展延不得超過五年。
再生醫療總結
目前的全球的再生醫療產業其實還有面臨以下幾個主要的瓶頸,包括醫療費用高昂、技術尚未成熟、法規較嚴格等因素影響。雖然各國在技術演進、法規放寬下有些許刺激更多業者進入這個領域,但目前主流保險都並沒有把再生醫療相關療法納入投保的範圍內,也因此減少患者使用到這項技術的誘因與機會。若未來再生醫療的技術發展得更加純熟,且有更多實際第二期、第三期的臨床應用產生,將會加速整個產業的發展進度。
【延伸閱讀】