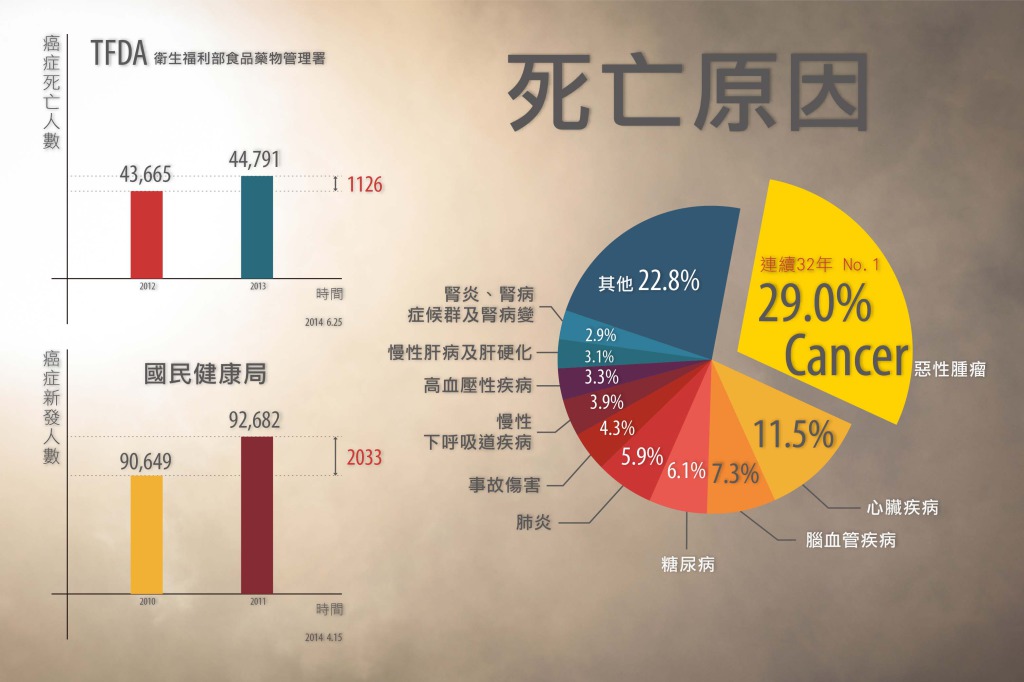
全球癌症病患增加快速,世界衛生組織於2014/02/04世界癌症日發表預測報告,指出未來20年癌症新發案例,將從2012年的每年1,400萬例增加到每年2,200萬例,增加幅度達57%!根據台灣衛生福利部2014/06/25公布的102年國人死因統計,癌症已連續32年佔據台灣死亡原因第一位。102年國人癌症死亡人數為44,791人,比前一年增加1,126人 [1]。另依據台灣國民健康局2014/04/15出爐的報告,2011年國內癌症新發人數較2010年增加2,033人。
自2010年之後,國內每年新增罹癌人口已超過九萬人,接受積極抗癌治療者約50萬人,而病情進展至末期階段者約4萬3千多人[2]。換言之,即便台灣有號稱全世界最好的健保,每年國人發生癌症或死於癌症的人數,仍年年遞增;無怪乎坊間盛傳各式各樣的非正統療法,從生機飲食、保健食品,到所謂各種自然免疫療法:營養免疫療法、運動免疫療法、精神免疫療法等等。這些充其量只能算是預防癌症的方法,卻被有心人士強調可以治療癌症,反映出當前有太多癌症無法治癒的事實。
然而,在全球日益擴大的癌症死亡陰影中,未必完全見不到一線曙光。甫被全球權威Science雜誌選為2013年度科學突破之最的癌症免疫療法(Cancer Immunotherapy) [3],兩位先驅:美國詹姆斯‧艾利森(James P. Allison)博士與日本的本庶佑(Tasuku Honjo)博士,更在2014年9月獲頒第一屆「唐獎」的生技醫藥獎,以表彰他們在癌症免疫治療領域的卓越貢獻。由台灣潤泰集團總裁尹衍樑先生捐助成立的「唐獎」,獎金比諾貝爾獎還要高,是目前全世界獎金最高的學術獎[4]。

[圖一:(左)艾利森博士、(右)本庶佑博士。Retrieved from:http://www.tang-prize.org/Publish.aspx?CNID=236 ]
免疫系統,包括白血球、淋巴球、免疫球蛋白(=抗體)等等,是人體內對抗細菌、病毒等入侵者的重要防線。長久以來,科學家與大眾一樣夢想著增強患者自身的免疫力去對抗癌細胞,但一百多年來卻一直無法成功應用在人體上,到1990年代時,幾乎所有的科學家都放棄了這個想法;但艾利森博士沒有放棄。
癌症免疫療法─CTLA-4抗體
1987年Nature雜誌上有篇短文(Letter),法國學者Brunet J.F.無意間發現小鼠的活化T淋巴球表面,有個未曾被人發現的接受體,與胞毒型T淋巴球的細胞毒殺作用調節有關;這個受體被命名為Cytotoxic T-lymphocyte Antigen 4 (CTLA-4) [5]。Brunet團隊並未將新發現與癌症做任何聯想,但他們的文章卻啟發了半個地球外的艾利森博士。
艾利森的團隊經過多年的努力,於1996年在Science雜誌發表,注射CTLA-4抗體將T淋巴球表面的CTLA-4阻斷,可成功縮小在小鼠身上的惡性腫瘤[6]。雖然動物實驗成功,印證了調控免疫系統確實可以治療癌症,但由於過去癌症免疫療法失敗的經驗,沒有任何大藥廠願意投資將CTLA-4抗體變成上市藥品;這個重責大任,最後落在一家1991年上市時,資本額約1千多萬美元的公司Medarex。然而,就在CTLA-4抗體第三期臨床試驗結果即將發表之前,2009年美國大藥廠必治妥施貴寶(Bristol-Myers Squibb, BMY-US),以超過20億美元併購了位於紐澤西的Medarex [3]。

以Ipilimumab為學名的CTLA-4抗體,進行兩個重要的第三期臨床試驗,由於這兩個重要的試驗成果,美國FDA已經於2011年3月份核准以YERVOY™為商品名的Ipilimumab,使用於無法手術或已經轉移的黑色素瘤病人。YERVOY™市場潛力之大,光2013一年的銷售額就高達9.6億美元;JP Morgan還預期2018-2020時,YERVOY™的全球營收將達到每年15億美元!目前在台灣已上市但未納入健保。
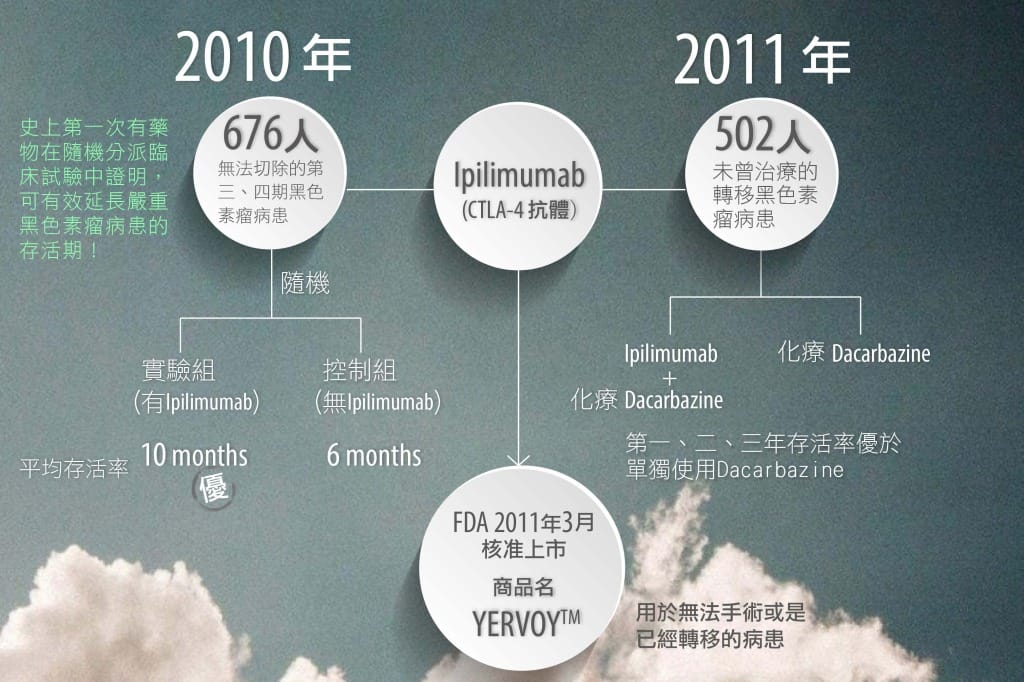
然而Medarex公司的遠見可不僅止於YERVOY™ (Ipilimumab)而已。所有動物細胞幾乎都有其生命週期,而許多細胞死亡前,細胞內的遺傳物質與蛋白質的產量不減反增,暗示細胞內有某個控制細胞走向凋亡的基因被啟動了。
癌症免疫療法 ─ PD-1抗體
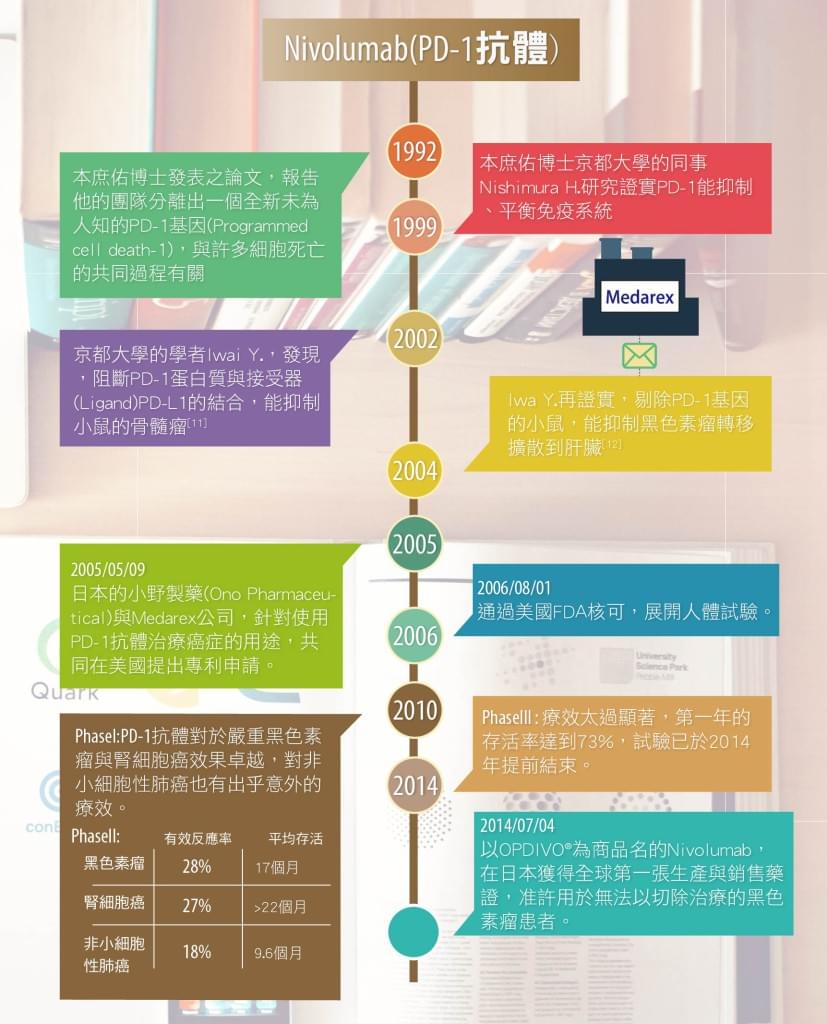
故事要從太平洋彼岸的日本說起,本庶佑博士於1992年發表論文,報告他的團隊分離出一個全新未為人知的PD-1基因(Programmed cell death-1),與許多細胞死亡的共同過程有關:當T淋巴球循計畫凋亡(Programmed cell death)時,細胞內的PD-1基因的表現會增加[9]。
1999年本庶佑博士京都大學的同事Nishimura H.研究,將PD-1基因剔除的小鼠,由於免疫系統過度旺盛,會攻擊正常組織,產生類似紅斑性狼瘡的自體免疫疾病[10];因而發現證實PD-1能抑制、平衡免疫系統。雖然本庶佑博士在1992年就發現PD-1基因,以及活化後T淋巴球表面的PD-1蛋白質,但從沒人將PD-1與治療癌症聯想到一起。
直到另一位京都大學的學者Iwai Y.,先是在2002年發現,阻斷PD-1蛋白質與接受器(Ligand)PD-L1的結合,能抑制小鼠的骨髓瘤[11];再於2004年證實,剔除PD-1基因的小鼠,能抑制黑色素瘤轉移擴散到肝臟[12]。
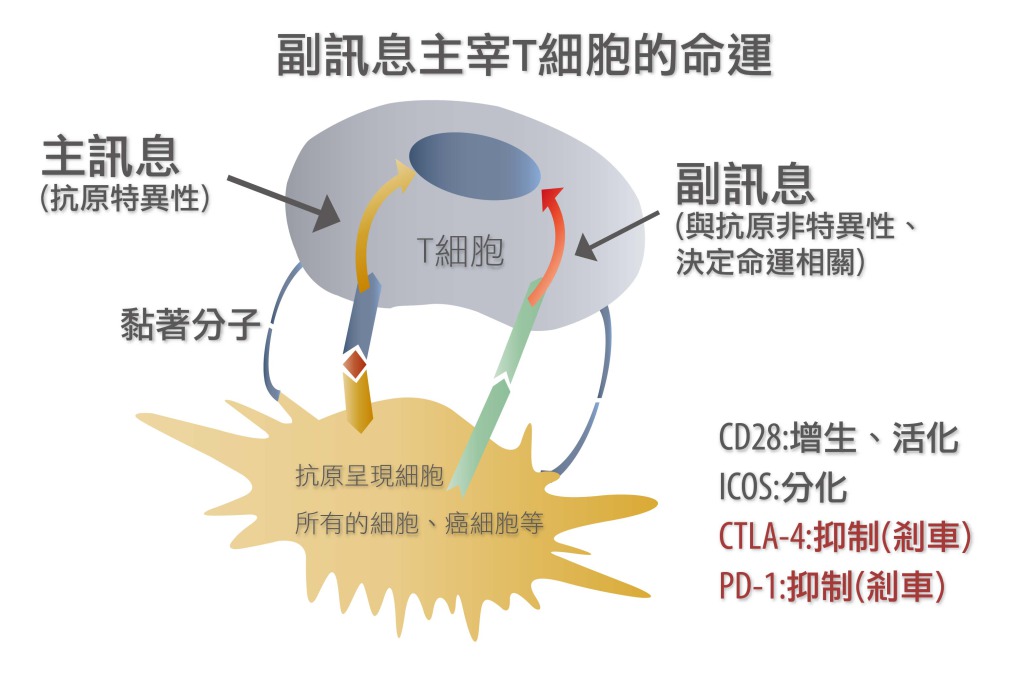
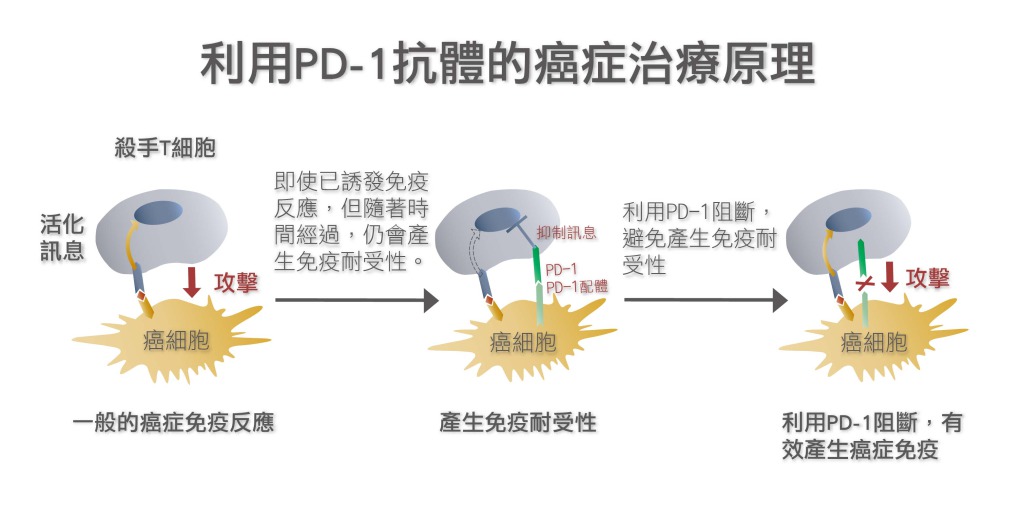
[圖二:(上)CTLA-4與PD-1抑制T淋巴球、(下)利用PD-1抗體治療癌症的原理。[13]
巴爾的摩的約翰霍普金斯大學,有位學者將京都大學的PD-1研究成果,告知了Medarex公司的某主管…;2005/05/09,日本的小野製藥(Ono Pharmaceutical)與Medarex公司,針對使用PD-1抗體治療癌症的用途,共同在美國提出專利申請;並在2006/08/01通過美國FDA核可,展開人體試驗。
2010年公布的兩個第一期臨床試驗發現,PD-1抗體對於嚴重黑色素瘤與腎細胞癌效果卓越,對非小細胞性肺癌也有出乎意外的療效。在此之後,以Nivolumab為學名的PD-1抗體,針對嚴重黑色素瘤患者,進行了第三期臨床試驗;但由於療效太過顯著,第一年的存活率達到73%,試驗已於2014年提前結束。
小野製藥在2014/07/04宣布,以OPDIVO®為商品名的Nivolumab,已在日本獲得全球第一張生產與銷售藥證,准許用於無法以切除治療的黑色素瘤患者。就合約內容約定,在日本、韓國、台灣之權利歸小野製藥,其他全球各地生產銷售Nivolumab的權利,都歸Medarex→必治妥施貴寶公司所有;預計於2015年就能在美國獲得批准生產上市。
CTLA-4抗體 : Ipilimumab V.S. PD-1抗體 : Nivolumab
單就治療嚴重黑色素瘤而言,PD-1抗體OPDIVO® (Nivolumab)的效果,看起來比CTLA-4抗體YERVOY™ (Ipilimumab)還要好;然而兩者之間真正的差別在於,PD-1的分布比CTLA-4更廣,包括B淋巴球、自然殺手細胞、調節型T淋巴球等等;因此,OPDIVO® (Nivolumab)不只作用在T淋巴球而已,也會連同B淋巴球、自然殺手細胞、調節型T淋巴球等等,一同對抗腫瘤。另一方面,目前已知許多種癌細胞都會表現PD-1接受器PD-L1、PD-L2,作為癌細胞逃脫免疫系統攻擊的機制。換句話說,與CTLA-4抗體Ipilimumab的適用範圍相比,PD-1抗體Nivolumab可以治療的癌症種類,簡直多到不勝枚舉;目前在全球進行的Nivolumab臨床試驗,治療目標包括非小細胞型肺癌、腎細胞癌、頭頸癌、神經膠質母細胞瘤、非何杰金氏淋巴瘤、卵巢癌等等,有單獨使用Nivolumab、也有併用其他治療方法的,林林總總超過五十項臨床試驗!以至於全球分析師對於OPDIVO® (Nivolumab)的銷售前景一致看好:多數認為在未來銷售高峰期可達每年50億美元,甚至有MorningStar分析師認為在最高峰可達一年100億美元!
癌症免疫療法的神話已實現?
免疫癌症療法的浪潮,在全球正方興未艾;然而卻也不是毫無缺點。例如:在Nivolumab第二期臨床試驗中,有14%受試者出現較嚴重的Grade 3-4藥物副作用,甚至有三位患者死於免疫反應相關的肺病變。 也有其他專家認為Ipilimumab 或Nivolumab在臨床試驗中對癌症的整體治癒率還是太低,病患的長期存活率不明;但是YERVOY™ (Ipilimumab)一個療程的費用就高達12萬美元,所費不貲。但無論如何,YERVOY™ (Ipilimumab)與OPDIVO® (Nivolumab)為癌症治療開啟了全新的視野:第一次以患者的免疫細胞為治療對象,而不是癌細胞。此外,在詹姆斯‧艾利森(James P. Allison)博士、與本庶佑(Tasuku Honjo)博士的「唐獎」得獎感想中,不約而同地都提到了基礎研究的重要性。人類對抗死神癌症的戰役可以說才剛剛開始,更新更好的治療永遠都派得上用場;當然也要負擔得起才行。
References:
[1] 102年國人死因統計結果. (2014/06/25). 台灣衛生福利部.
[2] 癌症海嘯來勢洶洶,癌症時鐘再度快轉. (2014/04/15). 台灣國民健康局.
[3] Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy. Science. 2013 Dec 20; 342(6165):1432-3.
[4] 唐獎第一屆生技醫藥獎. (2014/09/18). 唐獎基金會. Available at: http://www.tang-prize.org/Publish.aspx?CNID=236
[5] Brunet JF, Denizot F, Luciani MF,et al. A new member of the immunoglobulin superfamily–CTLA-4. Nature. 1987 Jul 16-22; 328(6127): 267-70.
[6] Leach DR1, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science. 1996 Mar 22;271(5256):1734-6.
[7] Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010; 363:711-723.
[8] Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med. 2011; 364:2517-2526.
[9] Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1 , a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992 Nov;11(11):3887-95.
[10] Nishimura H, Nose M, Hiai H, Minato N, Honjo T. Development of lupus-like autoimmune diseases by disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity. 1999 Aug;11(2):141-51.
[11] Iwai Y, Ishida M, Tanaka Y, et al. Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc Natl Acad Sci U S A. 2002 Sep 17;99(19):12293-7. Epub 2002 Sep 6.
[12] Iwai Y, Terawaki S, Honjo T. PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells. Int Immunol. 2005 Feb;17(2):133-44. Epub 2004 Dec 20.
[13] 本庶佑博士. 抗PD-1抗體之癌症治療基礎及臨床應用. (2013/09/23-24). 2013台日科技高峰論壇-轉譯醫學與生技產業發展. Available at: http://www.tnst.org.tw]


















全球CMOS影像感測器的領導廠商.png)
