何謂生物相似藥?
當原廠生物製劑(即大分子藥物)在專利保護到期之後,其他生物科技公司或是藥廠利用已有數據進行仿製且生產上市的藥品。
有別於小分子藥利用化學合成方式即可取得相同的分子結構,在專利到期後稱作『學名藥 (Generics) 』;大分子藥物是經由活細胞生產的3D複雜結構,製造過程的條件略作改變,即可能導致結構、純度、有效性的不同,因此他廠生產的藥品不可能完全與原廠相同,故專利到期後有不同的名稱,各國也衍生出不同的說法,在美國稱為第二代生物製劑Follow-on biologics;歐盟稱為相似性生物藥品Similar Biological Medicinal Products;大陸稱為生物仿製藥;台灣則習慣稱作生物相似藥。
大分子藥物的價格約是傳統化學治療藥物價格的二十倍,醫療費用十分高昂。醫療組織和政府機構為求降低生物製劑的售價,因此對生物相似藥的接受度與使用量日漸增加 ,尤其在新興國家市場。
生產方式比較
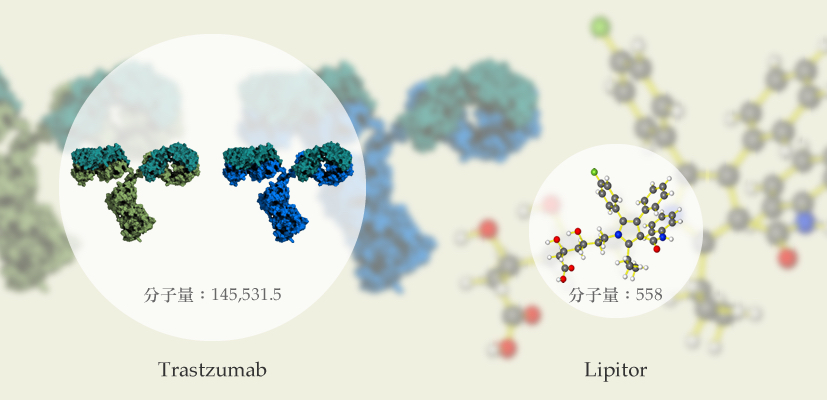
小分子學名藥品通常是化學合成,分子小而簡單,在實驗室內即可合成出相同分子結構的藥物。專利到期後,只要再做幾十人的「生物可利用性」與「生物相等性」的試驗,證明藥效與原廠藥相同後即可成為學名藥上市。其成本大約100~300萬美元。
大分子藥品本身屬三度空間結構,在生產相似藥時不可能和原廠藥百分之百相同,只能做到「相似」的程度。因極小的差異也可能導致生產的蛋白質表現出不想要的功能 ,例如:藥品無效或與預期療效有差異等問題,甚至可能影響免疫系統。
有鑑於此,上市生物相似藥品所依循的法規要求高出許多。由於以現有科技無法直接證明蛋白質結構是否相似,所以還是需要完整的臨床一期與三期試驗去證明其安全與效能才可申請上市 ;省略臨床二期,是因為二期的目的是要確認有效劑量,但原廠專利藥物已知此資訊了,直接沿用。此上市過程將花費至少上億。
生物相似藥相關法規
開發生物相似藥品會面臨到許多風險與問題,例如:與原廠藥品間要達到多高的相似度才可定義為相似藥?或是適應症是否應與原廠藥品完全相同?此等解答都依賴各國的法規定訂出統一的規範使市場有個遊戲規則可遵守依循。目前各國對於生物相似性藥品之法規設置已漸趨普遍。以下以歐洲、台灣、美國為例,簡介各國相關法規條款:
歐盟 (EMA) 於2005年擬定生物相似藥品規範(Guideline on Similar Bioligical Medicinal Products) ,內容指出生物相似藥品必需執行比較性研究來證實與原廠藥品有相似的本質。歐盟是第一個建立生物相似藥品法規的國家,可說是率先開啟了生物相似藥的市場,目前已有14項生物相似藥品通過藥品審核上市。
我國則參照歐盟法規,於2008年由行政院衛生署藥政處正式公佈『藥品查驗登記審查準則-生物相似性藥品查驗登記』,內容提供廠商在申請生物相似性藥品的指引外,也將各類影響用藥安全的風險因子納入規範中,加以預防管理。
美國雖是生物製劑的主要藥物開發市場,但關於生物相似藥品的法規—『生物藥品價格競爭與創新法案(Biologics Price Competition Innovation Act, BPCIA)』,是在2010年才通過,內容明定只要通過高度生物相似性或可替代性即可取得上市。為了促進生物相似藥上市,第一家對品牌藥提出Paragraph IV (P4)類型 (專利未到期前即提出上市申請,訴求產品未侵犯原廠專利或原廠專利無效) 挑戰成功且經核可上市的生物相似性藥品,可享有1年的市場銷售專屬權 ,若是小分子學名藥則只能享有180天。

生物相似藥生產技術複雜性高、投入的資金也相當高昂,即使成功通過法規審核上市,藥品的降價幅度也有限,價格的崩跌程度不似小分子化合物顯著。小分子學名藥由於和原廠藥物分子結構相同,在歐美的醫療政策是允許自動替換 ,即藥師可以自主使用學名藥替換原廠藥品而不須通知處方醫師。生物相似藥因不可能相同於原廠藥品,是故在歐盟法規中明確要求不允許自動替換,醫師與病患的接受程度及病人使用的便利性將成為很大的挑戰。而治療費用、蛋白質廠的產能、對原廠藥品的品牌忠誠度都將影響生物相似藥上市後的市場規模。
2013~2020年9成以上的大分子藥物專利將陸續到期,例如前十大生技藥品如 Enbrel、Remicade、Humira、Rituxan 等都將在 2016 前專利到期,釋出商機高達860億美元!讓全球生物相似藥市場帶來巨大的發展空間。許多大型製藥廠已紛紛投入生物相似藥品的開發,欲進入生物相似藥品市場,部分廠商更組成合作夥伴藉以取得更多技術資源,例如:Pfizer與Biocon、Amgen與Actavis,可以想見未來生物相似藥的市場競爭將會越來越激烈!















找藉口很簡單-改善投資績效卻很難.png)


